논문 "Discovery of AK-1690: A Potent and Highly Selective STAT6 PROTAC Degrader"는 새로운 PROTAC 분자인 AK-1690을 개발하여 STAT6 단백질을 타겟으로 하여 선택적으로 분해하는 메커니즘을 연구한 내용입니다.
연구의 진행 순서
- STAT6 리간드 디자인 및 SAR(구조-활성 관계, SAR) 연구: 연구는 기존에 알려진 STAT6 억제제를 기반으로, 다양한 화학적 modification을 통해 STAT6에 대한 binding afinity 를 높이는 새로운 리간드를 디자인하는 것에서 시작합니다. 처음에, STAT6 억제제의 modification을 통해 AK-068이 개발되었으며, 이는 STAT6에 대한 높은 binding afinity 를 가지고 있었으며, 특히 STAT5와 같은 다른 STAT 단백질에 비해 높은 선택성(selectivity)을 보였습니다.
- PROTAC 설계: AK-068을 기반으로 Cereblon 리간드를 결합하여 STAT6을 선택적으로 분해하는 PROTAC 분자인 AK-1690을 디자인했습니다. PROTAC 기술은 단백질을 분해하는 효과를 가지기 때문에 기존의 단순 inhibitor보다 더 효과적으로 STAT6 활성을 조절할 수 있는 전략으로 선택되었습니다. 이후 다양한 연결 부위와 연결 고리 길이를 최적화하는 과정에서 AK-1690이 도출되었습니다.
- CADD 분석: 컴퓨터 기반 약물 설계(CADD) 분석을 통해 STAT6 SH2 도메인과 AK-068의 결합 모델을 예측하고, 이를 통해 효율적인 결합을 유도하는 위치와 상호작용을 확인하였습니다. 이 분석은 STAT6 단백질의 특정 결합 부위에서의 친화도를 설명하고, 새로운 modification을 통한 SAR 연구에 기반한 최적화를 진행했습니다.
- 효능 및 선택성 평가: AK-1690은 다양한 세포 실험에서 STAT6을 선택적으로 분해하는 능력을 보였습니다. 특히 MV4;11 백혈병 세포주 및 L1236 호지킨 림프종 세포주에서 AK-1690은 STAT6 단백질을 매우 낮은 농도에서 효과적으로 분해하며, STAT1, STAT3, STAT5와 같은 다른 STAT 단백질에 미치는 영향은 거의 없었습니다.
- 단백질 분해 메커니즘 평가: HiBiT 바이오루미네선스 분석을 통해 AK-1690이 STAT6 단백질을 분해하는 메커니즘을 평가하였습니다. 이 실험을 통해 AK-1690이 Cereblon과 결합해 neddylation 과정이 필요함을 확인하였고, 이는 STAT6을 타겟으로 한 PROTAC으로서의 작용을 입증했습니다.
- In Vivo 효능 평가: AK-1690의 In Vivo 효능은 Balb/c 마우스를 이용하여 평가되었습니다. 200 mg/kg 용량으로 AK-1690을 투여한 결과, 2시간 후부터 24시간까지 간과 폐 조직에서 STAT6 단백질의 90% 이상이 분해됨을 확인했습니다.
주요 데이터 및 결과 정리 (표 요약)
- STAT6 및 STAT5A/B 결합 친화도 (Ki, nM):
- AK-068: STAT6 - 6 nM, STAT5A - 1000 nM, STAT5B - 500 nM.
- AK-1690의 STAT6 분해 효능 (DC50, nM):
- MV4;11 세포주: DC50 = 1 nM.
- L1236 세포주: DC50 = 80 nM.
- 미세 소체 및 혈장 안정성 (각 종별):
- 인간: 미세 소체 T1/2 > 120분, 혈장 T1/2 > 120분.
- 마우스: 미세 소체 T1/2 > 120분, 혈장 T1/2 > 120분.
- In Vivo STAT6 분해 (간 및 폐 조직, 200 mg/kg 투여 후 STAT6 분해율):
- 간: 2시간, 6시간, 24시간 모두 >90% 분해.
- 폐: 2시간 >70%, 6시간 >90%, 24시간 >70% 분해.
결론 및 시사점
AK-1690은 STAT6 타겟으로 매우 강력한 선택적 분해 효과를 보이는 최초의 PROTAC입니다. 이 분자는 다양한 세포 실험과 동물 실험에서 STAT6 단백질의 효과적인 분해를 유도하며, 기존의 억제제와 비교하여 월등한 선택성과 효능을 보였습니다. 특히 STAT6이 관여하는 다양한 질병에서 중요한 연구 도구로 활용될 수 있으며, 향후 STAT6을 타겟으로 하는 신약 개발에 중요한 기여를 할 것으로 기대됩니다.
-실험데이터 분석-

Table 1: 신약 STAT6 리간드 디자인
이 테이블은 논문에서 새롭게 디자인된 STAT6 리간드들의 특징과 약리적 데이터를 요약한 내용입니다. 각 화합물의 구조적 modification 과 그에 따른 약리적 성능을 비교하여, 새로운 PROTAC 설계가 목표로 했던 STAT6의 결합과 선택성을 어떻게 최적화했는지 보여줍니다.
- 각 화합물의 화학 구조: 테이블에는 각 리간드가 갖는 핵심 화학적 구조의 특징이 나열되어 있습니다. 예를 들어, 리간드에서 변형된 아미노산 부분, 접합부, 링 구조 등은 STAT6 단백질에 대한 Binding Affinity 와 효능에 중요한 영향을 미칩니다.
- 결합 친화도 (Binding Affinity): 각 리간드가 STAT6에 얼마나 강하게 결합하는지를 나타내는 데이터를 보여줍니다. 이 수치는 화합물의 효능을 판단하는 데 중요한 요소로, 더 낮은 값일수록 더 강한 결합력을 의미합니다. 예를 들어, 테이블에서 보이는 IC50 값이 낮을수록 STAT6에 대한 더 높은 선택적 결합을 나타냅니다.
- 선택성 (Selectivity): 선택성 데이터는 리간드가 다른 STAT 단백질 (예: STAT3, STAT5 등)보다 STAT6에 얼마나 더 특이적으로 결합하는지를 평가합니다. 선택성이 높은 화합물일수록, 타겟 단백질인 STAT6에만 선택적으로 작용하며 부작용을 줄일 가능성이 높습니다.
이 테이블은 STAT6을 표적으로 하는 새로운 PROTAC 리간드들이 기존 약물과 비교했을 때 더 나은 효능과 선택성을 가짐을 확인하였으며, 각 구조의 modification 이 어떻게 Binding Affinity 와 selectivity에 영향을 미쳤는지를 보여줍니다.

Figure 1: STAT6과 결합한 화합물 2의 예측 결합 모델
그림 1에서는 화합물 2가 STAT6 SH2 도메인과 어떻게 결합하는지를 이해하기 위해 모델링한 두 가지 결합 모델을 보여줍니다. 이 두 모델은 1,2,3,4-테트라히드로이소퀴놀린 부분의 방향에 따라 차이가 있습니다:
- 결합 모델 1 (청록색):
- 테트라히드로이소퀴놀린 부분이 Gln590과 Arg605 사이의 틈에 위치합니다.
- 이 모델의 결합 에너지는 −6.0 kcal/mol입니다.
- 결합 모델 2 (녹색):
- 같은 부분이 Ile573, Phe592, Leu609, Leu612로 형성된 hydrophobic pocket(소수성 주머니)에 위치합니다.
- 이 모델의 결합 에너지는 −4.3 kcal/mol로 다소 낮습니다.
두 모델 모두에서 벤조티오펜 기반 인산화 티로신 유도체는 Lys480, Arg562, Arg510으로 구성된 양전하 주머니에 결합합니다. 이러한 상호작용은 연구진이 이전에 연구했던 STAT3와 STAT5의 리간드 결합 구조와 유사합니다.
추가로:
- Ser564와 Arg562가 di-F 그룹과 수소 결합을 형성합니다.
- 벤조티오펜 그룹은 Pro591과 근접하게 있으며, t-부틸 그룹은 용매에 노출되지만 Glu587과 접촉하고 있습니다.
이 결합 모델들은 구조-활성 관계(SAR) 연구에서 추가적인 최적화를 위해 중요한 가이드를 제공했습니다.

Table 2: C-말단 amide 결합과 인산화 티로신 유도체가 STAT6 결합 친화도에 미치는 영향
테이블 2는 화합물의 C-말단 amide 결합과 인산화 티로신 유도체(phosphotyrosine mimetics)가 STAT6 결합에 미치는 영향을 분석한 데이터를 제공합니다. 이를 통해 리간드의 구조적 변형이 결합 친화도에 어떻게 영향을 미치는지 확인할 수 있습니다.
- C-말단 amide 결합의 중요성:
- 연구진은 AK-068의 C-말단에 위치한 amide 결합을 변형해 결합 친화도에 미치는 영향을 평가했습니다.
- 이를 위해 amide 결합을 메틸렌 결합으로 바꾼 화합물 25를 합성한 결과, STAT6에 대한 Ki 값이 2.0 μM으로 나타나 AK-068보다 300배 낮은 결합력을 보였습니다. 이로 인해 amide 결합이 높은 결합 친화도를 유지하는 데 매우 중요하다는 사실을 확인했습니다.
- 인산화 티로신 유도체의 변형:
- 연구진은 AK-068에서 사용한 벤조티오펜 기반 인산화 티로신 유도체를 나프탈렌 기반 유도체로 변경한 화합물 26과 27을 설계했습니다.
- 화합물 26은 (R)-3-모르폴린 구조를 갖고 있으며, Ki = 660 nM으로 AK-068보다 100배 낮은 결합 친화도를 보였습니다.
- 화합물 27은 (S)-3-모르폴린 구조를 갖고 있으며, Ki = 3.0 μM으로 해당 아날로그 9에 비해 4배 낮은 친화도를 보였습니다.
이 데이터를 통해 C-말단 아마이드 결합과 인산화 티로신 유도체의 구조적 변화가 STAT6과의 결합 친화도에 매우 중요한 역할을 한다는 결론을 얻었습니다.
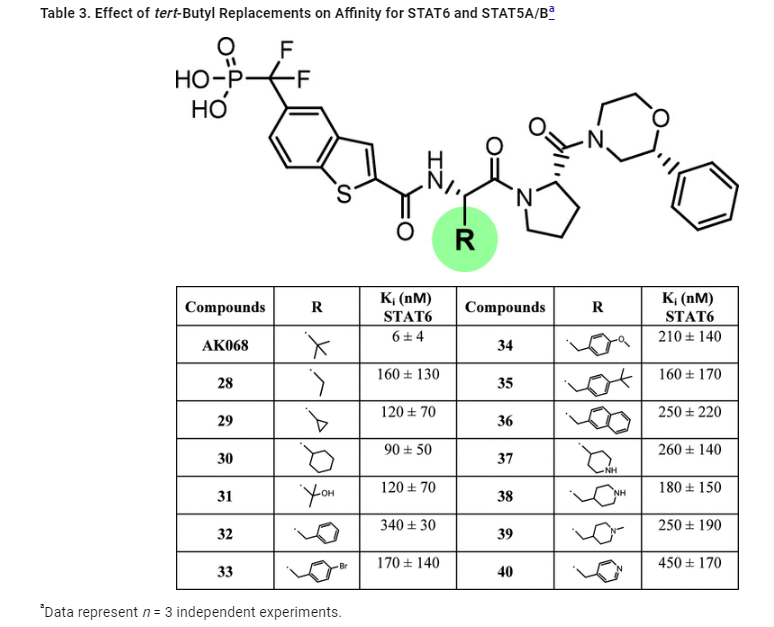
Table 3 설명 및 분석:
테이블 3은 tert-Butyl 그룹의 치환이 STAT6와 STAT5A/B에 대한 결합 친화도에 미치는 영향을 설명하고 있습니다.
AK-068의 tert-Butyl 그룹은 STAT6 단백질과의 결합에서 중요한 역할을 한다고 알려져 있으며, 이 그룹을 대체하는 다양한 알리파틱 또는 방향족 소수성 그룹들이 STAT6에 대한 결합에 어떤 영향을 미치는지 분석한 결과가 나와 있습니다.
주요 데이터 확인:
- tert-Butyl 그룹 치환: 여러 가지 치환 그룹들이 AK-068에 추가되었고, 이들 화합물들의 STAT6과의 결합 친화도를 분석한 결과가 제시되어 있습니다.
- 28-36번 화합물들은 90-340nM의 Ki 값으로 STAT6과 잘 결합하였으나, AK-068보다는 상대적으로 덜 강한 결합력을 보였습니다.
- 따라서, 이러한 소수성 그룹의 치환이 STAT6와의 결합에서 어느 정도의 친화도를 유지할 수는 있지만, 최적화된 구조는 AK-068의 구조임을 시사합니다.
- 양전하 그룹 추가: tert-Butyl 그룹이 STAT6의 Glu587과 가까운 위치에 있어 양전하를 띤 그룹이 Glu587의 음전하와 상호작용할 수 있는 가능성을 고려하여 여러 양전하를 띤 치환 그룹(37-40번 화합물)이 설계되었습니다.
- 이들 그룹은 180-450nM의 Ki 값을 기록하였지만, AK-068에 비해 30배 이상 덜 강한 결합력을 보였습니다.
- 이는 이론상 예상되는 전기적 상호작용이 실제로 결합 친화도에 큰 영향을 미치지 않는다는 것을 보여줍니다.
결론:
- tert-Butyl 그룹은 AK-068에서 결합 친화도를 유지하는 데 중요한 역할을 하며, 소수성 그룹을 대체하거나 양전하를 가진 그룹으로 대체하는 것은 결과적으로 결합력 저하로 이어집니다.
- 따라서, tert-Butyl 그룹의 구조적 위치는 STAT6과의 상호작용에서 최적화된 상태로, 다른 치환은 이와 같은 효과를 발휘하지 못합니다.
이 표는 STAT6 결합 친화도를 최적화하는 데 있어 소수성 치환과 전하 상호작용의 중요성을 시사하며, 구조적 최적화의 필요성을 보여줍니다.
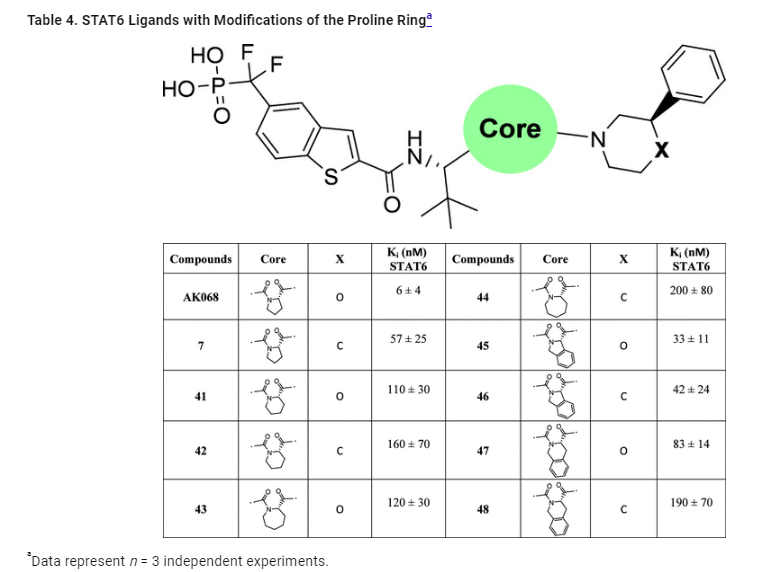
Table 4: 프로린 링 modification을 포함한 STAT6 리간드 분석
테이블 4는 프로린 링의 modification 이 STAT6 리간드의 결합 친화도에 미치는 영향을 보여줍니다. AK-068의 프로린 링을 modification 하여 여러 유도체를 디자인한 후, 이들이 STAT6과 어떻게 상호작용하는지를 분석한 결과가 나옵니다.
주요 포인트:
- 프로린 링에서 6각형 피페리딘 링으로 modification :
- 프로린 링을 6각형 피페리딘 링으로 modification 한 결과, 화합물 41과 42는 각각 Ki = 110 nM과 160 nM의 결합 친화도를 보였습니다.
- 이는 AK-068에 비해 17배 낮은 결합 친화도를 나타냅니다.
- 7각형 아제파닐 링으로 modification :
- 5각형 프로린 링을 7각형 아제파닐 링으로 modification 한 화합물 43과 44도 유사한 결과를 보였으며, 결합 친화도가 AK-068에 비해 낮아졌습니다.
- 이 데이터는 링 크기 변화가 STAT6 결합에 부정적인 영향을 미친다는 사실을 보여줍니다.
- 프로린 링에 퓨즈드 페닐 그룹 추가:
- 프로린 링에 퓨즈드 페닐 그룹을 추가한 화합물 45와 46은 각각 33 nM과 44 nM의 Ki 값을 보였으며, 결합 친화도가 크게 개선되었습니다.
- 이 변형은 STAT6 결합에 긍정적인 영향을 미치며, 구조적 modification 이 결합력에 미치는 효과를 입증합니다.
- 피페리딘 링에 페닐 그룹 추가:
- 6각형 피페리딘 링에 퓨즈드 페닐 그룹을 추가한 화합물 47과 48도 유사한 친화도를 나타내었으며, 이는 결합력이 향상된 구조임을 확인할 수 있습니다.
결론:
- 프로린 링 modification은 STAT6 결합 친화도에 큰 영향을 미칩니다. 특히, 퓨즈드 페닐 그룹을 추가하면 결합력이 크게 향상되며, 이는 새로운 리간드 설계 시 고려할 수 있는 중요한 요소입니다.
- 반면에, 링 크기의 변화는 결합력에 부정적인 영향을 미칠 수 있으므로, 구조적 최적화에서 중요한 변수로 작용합니다.
이 분석은 STAT6과의 결합력을 최적화하기 위한 구조적 modification 의 중요성을 시사하며, 향후 리간드 디자인에서 중요한 기준이 될 수 있습니다.
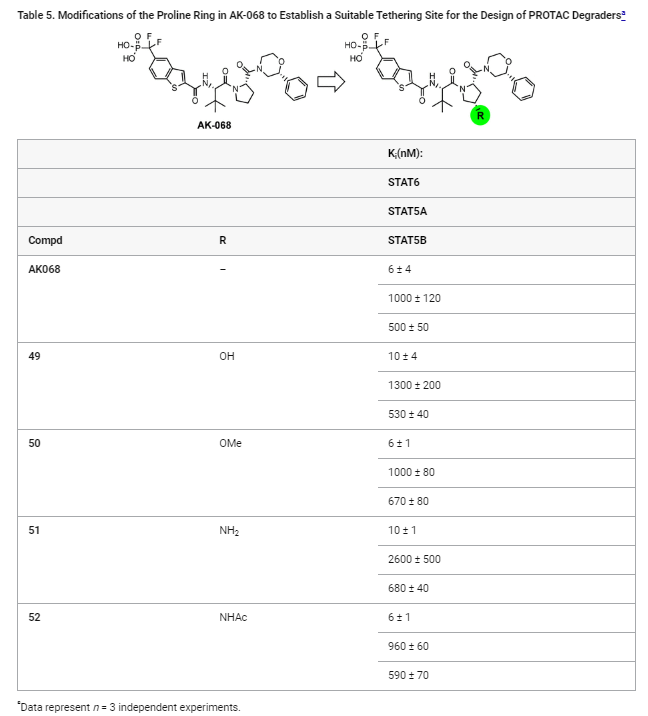
Table 5: AK-068의 프로린 링 modification을 통한 PROTAC 디자인용 테더링 부위 확보
Table 5는 AK-068의 프로린 링을 modification 하여 PROTAC 설계에 적합한 테더링(tethering) 부위를 찾기 위한 실험 결과를 보여줍니다. 이 테이블은 프로린 링에 다양한 치환기나 modification을 도입한 화합물들이 STAT6에 대한 결합 친화도와 STAT5A/B에 대한 선택성에 미치는 영향을 분석하고 있습니다.
주요 내용:
- AK-068:
- 이 화합물은 테더링 변형 없이 사용되었으며, STAT6에 대한 Ki 값은 6 nM, STAT5A/B에 대해서는 각각 1000 nM과 500 nM으로 나타났습니다.
- 이는 STAT6에 대한 높은 선택성과 결합 친화도를 보여줍니다.
- 화합물 49 (OH 치환):
- 프로린 링에 하이드록시(OH) 치환기를 추가한 화합물로, STAT6에 대한 Ki 값은 10 nM입니다.
- STAT5A/B에 대해서는 각각 1300 nM과 530 nM으로 결합 친화도가 약간 감소하였으나 여전히 높은 선택성을 유지했습니다.
- 화합물 50 (OMe 치환):
- 메톡시(OMe) 그룹으로 치환된 화합물로, STAT6에 대해 6 nM의 Ki 값을 나타내며, STAT5A/B에 대해서는 각각 1000 nM과 670 nM의 친화도를 보였습니다.
- 이 결과는 메톡시 그룹이 결합 친화도에 거의 영향을 미치지 않음을 보여줍니다.
- 화합물 51 (NH2 치환):
- 프로린 링에 아미노(NH2) 그룹을 추가한 화합물입니다. STAT6에 대한 Ki 값은 10 nM이며, STAT5A/B에 대해서는 각각 2600 nM과 680 nM의 값이 나왔습니다.
- 이는 STAT6에 대한 결합 친화도가 약간 감소하고, STAT5에 대한 선택성도 일부 낮아졌음을 나타냅니다.
- 화합물 52 (NHAc 치환):
- 아세틸화 아미노(NHAc) 그룹을 추가한 화합물로, STAT6에 대한 Ki 값은 6 nM, STAT5A/B에 대해서는 각각 960 nM과 590 nM의 값을 보였습니다.
- 이는 NHAc 치환이 결합 친화도에 거의 영향을 미치지 않음을 나타냅니다.
결론:
- 이 테이블은 AK-068의 프로린 링에 다양한 치환기를 추가하여 PROTAC 디자인에서 Cereblon 리간드와 연결할 수 있는 테더링 부위를 확보하려는 시도를 설명합니다.
- 결과적으로, 이러한 치환이 STAT6에 대한 결합 친화도에 큰 영향을 미치지 않았으며, 대부분의 경우 STAT6에 대한 높은 선택성을 유지하면서도 테더링 부위를 제공할 수 있었습니다.
- 이를 통해 PROTAC 디자인에 적합한 부위를 선택할 수 있게 되었으며, 특히 OH 또는 OMe 치환은 STAT6 결합 친화도에 거의 영향을 미치지 않으면서 유용한 테더링 부위로 사용할 수 있음을 확인할 수 있었습니다.
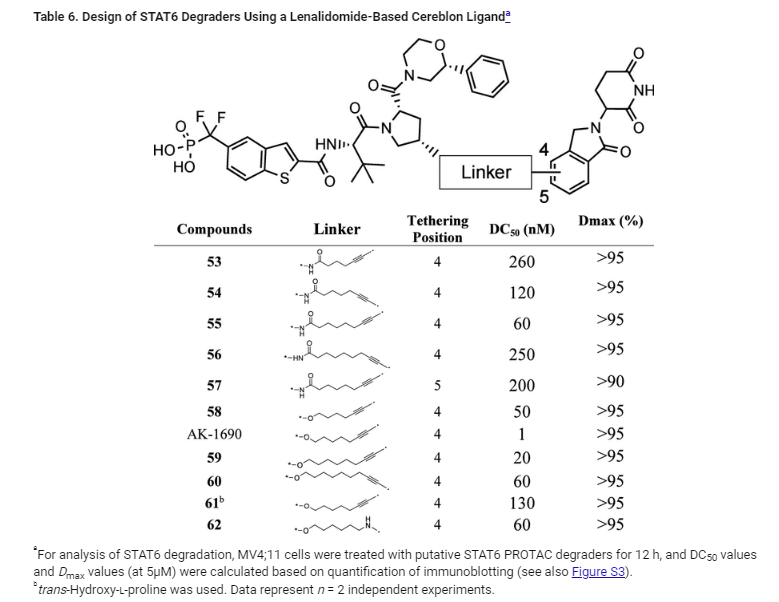
Table 6: 레날리도마이드 기반의 Cereblon 리간드를 사용한 STAT6 분해제 설계
Table 6은 레날리도마이드 기반의 Cereblon 리간드를 사용하여 설계된 STAT6 PROTAC 분해제들의 구조적 modification과 그에 따른 STAT6 단백질 분해 능력을 보여줍니다. 각 화합물은 MV4;11 백혈병 세포주에서 STAT6 단백질의 분해 효율을 평가한 값들로 요약됩니다.
주요 데이터:
- 53–56번 화합물:
- AK-068을 기반으로 하여 레날리도마이드(Cereblon 리간드)를 연결한 PROTAC 분해제입니다. 각 화합물은 STAT6 분해 효율을 나타내는 DC50 값을 통해 비교됩니다.
- DC50 값은 260 nM에서 60 nM까지 다양하며, 이는 각 화합물이 STAT6 단백질을 얼마나 효과적으로 분해하는지를 나타냅니다.
- 예를 들어, 화합물 55는 DC50 = 60 nM으로 STAT6 단백질을 가장 효과적으로 분해했습니다.
- 화합물 57:
- 레날리도마이드의 4번 위치가 아닌 5번 위치에 연결한 화합물입니다. 이 화합물의 DC50 값은 200 nM으로, 화합물 55에 비해 4배 덜 효과적입니다. 이 데이터는 레날리도마이드 연결 부위가 STAT6 분해 효율에 중요한 역할을 한다는 것을 보여줍니다.
- 58, AK-1690, 59, 60:
- 레날리도마이드와 STAT6 리간드를 연결하는 아마이드 그룹을 에터 그룹으로 변형하여 디자인된 화합물들입니다.
- 이들 화합물은 매우 높은 STAT6 분해 효율을 보였으며, 특히 AK-1690은 DC50 = 1 nM으로, 가장 강력한 STAT6 분해제로 확인되었습니다.
- AK-1690은 Dmax > 95%로 STAT6 단백질의 거의 모든 부분을 분해할 수 있음을 보여줍니다.
- 화합물 61:
- trans-하이드록시-L-프로린을 사용한 변형체로, DC50 = 130 nM을 기록했습니다. 이 화합물은 AK-1690보다 100배 덜 효과적이었으며, 링커의 방향성이 STAT6 분해 효율에 중요한 영향을 미친다는 것을 시사합니다.
결론:
- 테이블 6은 레날리도마이드 기반 Cereblon 리간드를 연결하여 STAT6 분해 효율을 향상시키는 전략을 보여줍니다.
- AK-1690은 가장 강력한 STAT6 분해제로, 1 nM 수준의 DC50 값을 통해 매우 높은 분해 효율을 기록했습니다.
- 또한, 레날리도마이드의 연결 위치와 링커의 구조적 특성이 PROTAC 디자인에서 중요한 요소임을 확인할 수 있습니다.
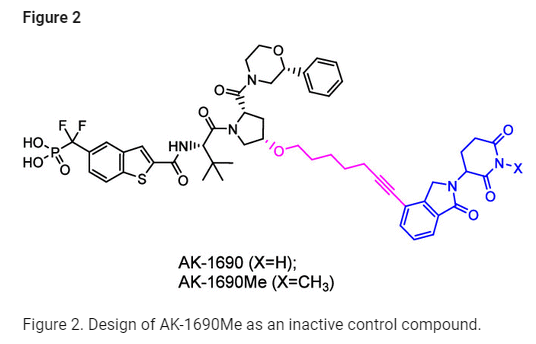
Figure 2: AK-1690Me 비활성 대조 화합물의 디자인
이 그림은 연구팀이 AK-1690의 비활성 대조 화합물로 디자인한 AK-1690Me의 구조와 설계 전략을 설명합니다. AK-1690Me는 STAT6 단백질의 결합 활성에 영향을 미치지 않으면서 STAT6를 목표로 하는 PROTAC 분해 메커니즘에서 유효성을 시험하기 위해 개발되었습니다.
설계 전략:
- 메틸화 변형: AK-1690Me는 AK-1690 구조의 특정 부위에 메틸기를 도입하여 PROTAC 활성의 중요한 상호작용을 억제하는 전략을 사용했습니다. 메틸화는 특히 리간드가 단백질 표적의 활성 부위에서 핵심 상호작용을 하지 못하도록 디자인되었습니다. 이를 통해 AK-1690과 비교해 이 화합물이 단백질 분해에 관여하지 않음을 확인할 수 있습니다.
- STAT6 결합 저해 효과: AK-1690Me는 STAT6 결합 부위에서 AK-1690과 다른 작용을 합니다. 메틸기 도입으로 인한 결합 친화력 감소는 실험을 통해 STAT6에 대한 결합 저해를 검증하는 데 중요한 역할을 합니다.
따라서 이 그림은 메틸화와 같은 화학적 변형이 단백질과 화합물 간의 결합을 어떻게 방해하는지 보여주며, 이는 PROTAC 기술이 정확히 타겟 단백질을 분해할 수 있는지를 평가하는 데 중요한 참고 자료가 됩니다.
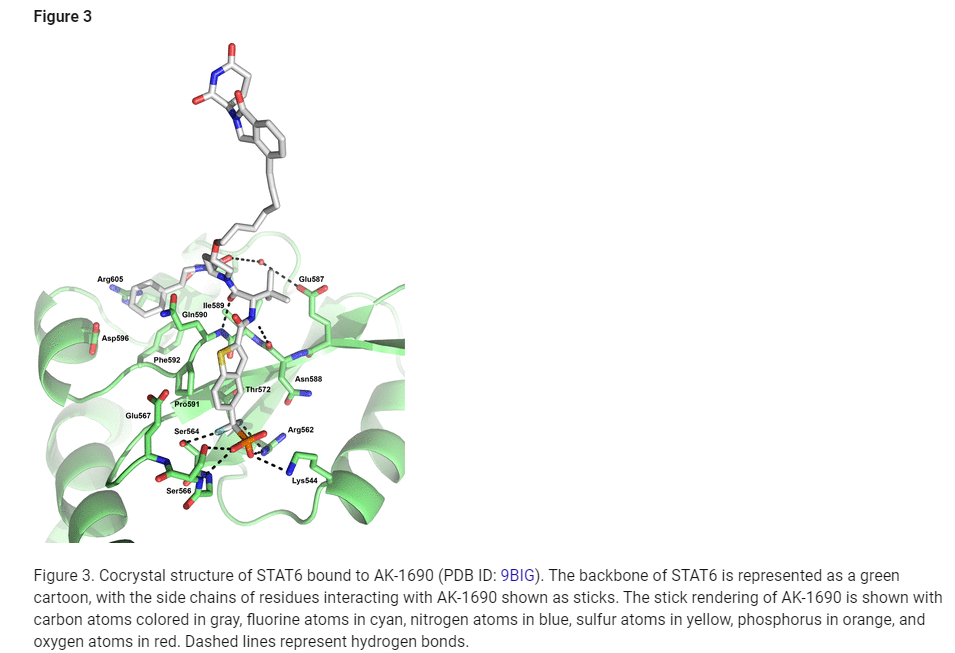
Figure 3: AK-1690과 결합한 STAT6의 공동결정 구조 (PDB ID: 9BIG)
그림 3은 STAT6 단백질이 AK-1690과 결합한 공동결정 구조를 보여줍니다. 이 그림은 STAT6 단백질의 구조와 AK-1690이 특정 잔기들과 어떻게 상호작용하는지를 시각적으로 표현하고 있습니다.
구조 설명:
- STAT6의 기본 구조:
- STAT6 단백질의 백본(Backbone)은 녹색 카툰으로 표현되어 있으며, 단백질의 전반적인 3차원 구조를 나타냅니다.
- STAT6의 측쇄(Side chains) 중에서 AK-1690과 상호작용하는 특정 잔기들은 스틱(sticks) 형태로 그려져 있습니다.
- AK-1690의 구조:
- AK-1690의 탄소 원자는 회색으로, 플루오린 원자는 청록색, 질소 원자는 파란색, 황 원자는 노란색, 인 원자는 주황색, 그리고 산소 원자는 빨간색으로 표시되었습니다.
- 이러한 색상 코드는 화학 구조의 각 부분을 명확히 구분하여, 분자의 화학적 상호작용을 쉽게 이해할 수 있게 해 줍니다.
- 수소 결합:
- 점선은 AK-1690과 STAT6 사이에 형성된 수소 결합을 나타냅니다. 수소 결합은 단백질과 리간드가 안정적으로 결합하는 데 중요한 상호작용을 제공합니다.
- 이러한 수소 결합은 AK-1690이 STAT6에 강하게 결합하는 기전을 설명하는 중요한 요소입니다.
결과:
이 공동결정 구조는 AK-1690이 STAT6의 특정 부위에 어떻게 결합하는지 명확히 보여줍니다. 이를 통해 연구진은 AK-1690이 STAT6을 효율적으로 타겟팅하고 분해할 수 있는 구조적 기초를 제공받을 수 있었습니다. 또한, 이 구조는 STAT6과의 상호작용을 최적화하기 위한 PROTAC 디자인의 근거가 됩니다.
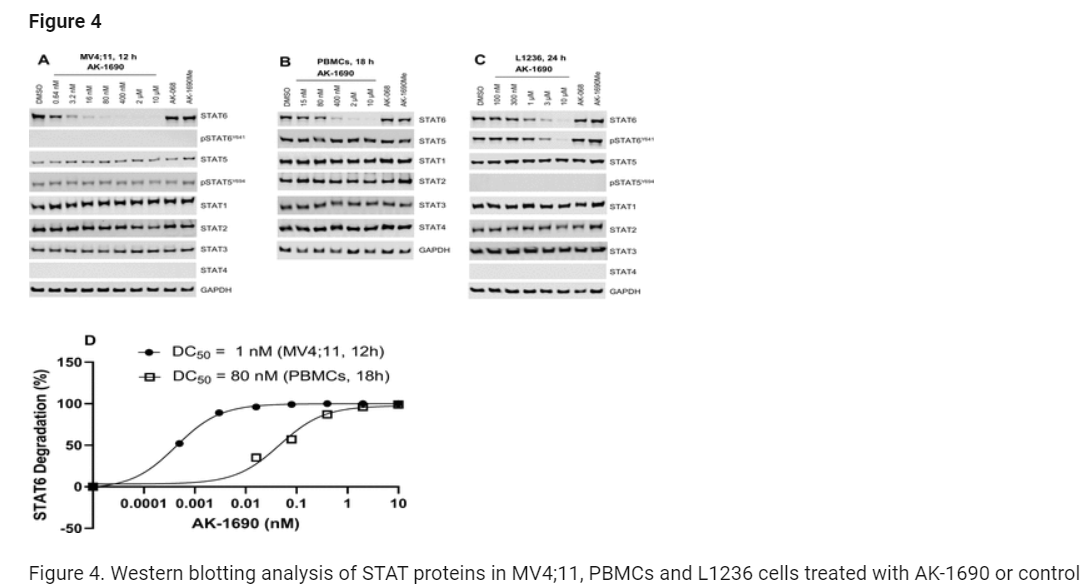
Figure 4: AK-1690 또는 대조 화합물로 처리한 MV4;11, PBMC, L1236 세포의 STAT 단백질에 대한 웨스턴 블롯 분석
그림 4는 STAT6 분해를 평가하기 위해 AK-1690과 대조 화합물인 AK-068 및 AK-1690Me로 처리한 다양한 세포에서의 웨스턴 블롯(Western Blot) 실험 결과를 보여줍니다. 이 그림은 AK-1690이 STAT6 단백질을 효과적으로 분해하는지 확인하는 실험으로, MV4;11 세포주, 인간 말초 혈액 단핵세포(PBMC), 그리고 L1236 호지킨 림프종 세포주에서 이루어졌습니다.
(A) MV4;11 세포 처리 결과:
- MV4;11 세포는 12시간 동안 AK-1690과 다른 화합물로 처리되었습니다.
- AK-1690은 DC50 = 1 nM에서 STAT6 단백질을 효과적으로 분해했으며, 95% 이상의 STAT6이 제거되었습니다.
- 대조군인 AK-068(STAT6 리간드)은 STAT6을 분해하지 못했으며, AK-1690Me(비활성 STAT6 분해제) 역시 STAT6 단백질에 영향을 미치지 않았습니다.
- 다른 STAT 단백질인 STAT1, STAT3, STAT5는 10 μM의 AK-1690 농도에서도 영향을 받지 않았습니다.
(B) PBMC 처리 결과:
- PBMC 세포는 18시간 동안 처리되었으며, AK-1690은 DC50 = 80 nM에서 STAT6 단백질을 효과적으로 분해했습니다.
- 다른 STAT 단백질들은 AK-1690에 의해 거의 영향을 받지 않았습니다.
- AK-068과 AK-1690Me는 STAT6을 분해하지 않았습니다.
(C) L1236 세포 처리 결과:
- L1236 호지킨 림프종 세포주는 24시간 동안 처리되었으며, AK-1690은 총 STAT6과 인산화된 STAT6(pSTAT6Y641) 단백질을 농도 의존적으로 감소시켰습니다.
- AK-068과 AK-1690Me는 STAT6이나 pSTAT6에 영향을 미치지 않았습니다.
(D) STAT6 분해 정량화:
- STAT6 분해는 MV4;11 세포주와 PBMC에서 AK-1690에 의해 효과적으로 이루어졌으며, 각각의 실험에서 3번의 독립적인 실험 데이터를 통해 확인되었습니다.
결과:
- 이 실험을 통해 AK-1690은 STAT6을 매우 선택적으로 분해하며, 다른 STAT 단백질에는 영향을 미치지 않는다는 사실이 확인되었습니다.
- AK-068은 STAT6에 대한 높은 결합력을 가지고 있지만, STAT6을 분해하지는 못했습니다. 반면, AK-1690Me는 비활성 PROTAC으로, STAT6을 분해하지 못했습니다.
이 결과는 AK-1690이 STAT6을 타겟으로 하는 매우 강력하고 선택적인 PROTAC이라는 사실을 뒷받침합니다.
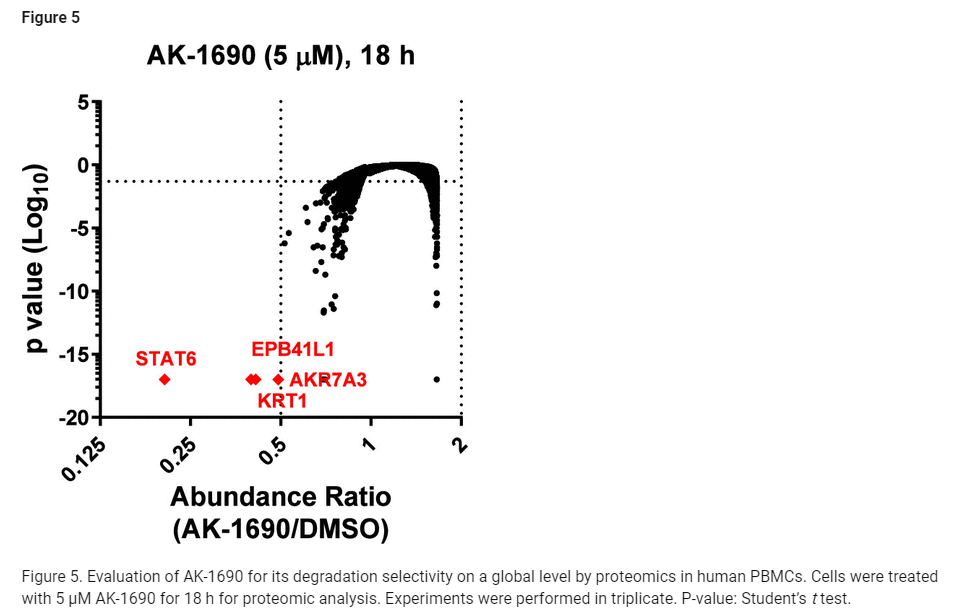
Figure 5: 인간 PBMC에서의 AK-1690 글로벌 단백질 분해 선택성 평가 (프로테오믹스 분석)
그림 5는 인간 PBMC(말초 혈액 단핵세포)에서 AK-1690이 STAT6을 선택적으로 분해하는지 확인하기 위해 수행된 프로테오믹스 분석 결과를 보여줍니다. AK-1690을 5 μM 농도로 18시간 처리한 후, 세포 내 단백질 변화가 어떻게 이루어졌는지를 전반적으로 평가하였습니다.
주요 내용:
- 글로벌 단백질 수준 변화:
- AK-1690 처리 후, 6,000개 이상의 단백질 중 4개의 단백질 수준이 50% 이상 감소했습니다.
- 이 중 STAT6 단백질 수준은 79% 감소하여, AK-1690이 STAT6에 대해 강력한 분해 능력을 발휘했음을 보여줍니다.
- 그 외 감소한 단백질들은 EPB41L1(에리트로사이트 막 단백질 4.1), KRT1(케라틴 1), AKR7A3(알도-케토 환원효소 7A3)로 각각 60%, 59%, 51% 감소했습니다.
- STAT 단백질군의 안정성:
- STAT1, STAT2, STAT3, STAT4, STAT5 등 다른 STAT 단백질들의 수준은 AK-1690에 의해 유의미하게 변화하지 않았습니다. 이는 AK-1690이 STAT6에 대해 높은 선택성을 가진다는 것을 보여줍니다.
- 통계적 분석:
- 실험은 세 번의 독립적인 반복 실험으로 진행되었으며, Student’s t-test를 사용하여 통계적 유의성을 평가했습니다. 이는 결과의 신뢰성을 보장하는 중요한 요소입니다.
결론:
- AK-1690은 글로벌 수준에서 단백질을 선택적으로 분해하며, 특히 STAT6 단백질을 매우 강력하게 타겟팅한다는 것을 확인할 수 있었습니다.
- 다른 STAT 단백질군에는 영향을 거의 미치지 않으면서도, STAT6을 선택적으로 분해하는 능력은 AK-1690의 높은 선택성을 입증하는 중요한 결과입니다.
- 이 데이터를 바탕으로 AK-1690이 STAT6 분해를 목표로 한 약물 디자인에서 중요한 역할을 할 수 있으며, 비특이적 단백질 분해 위험이 적다는 것을 확인할 수 있습니다.
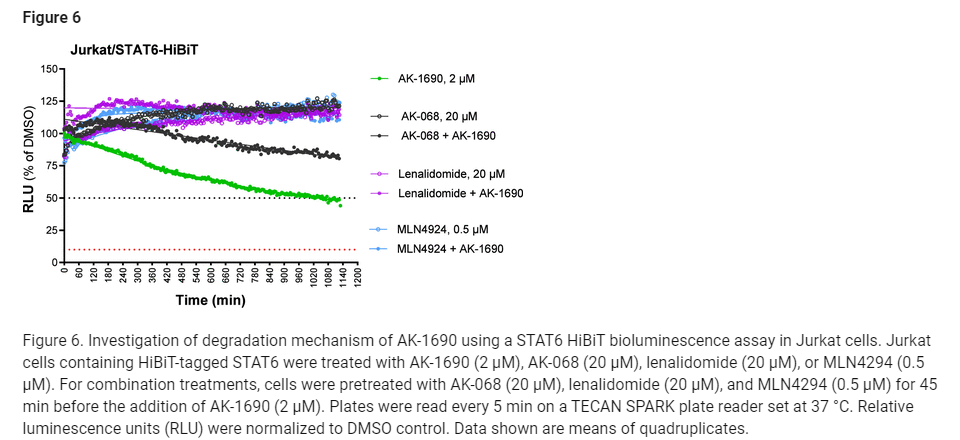
Figure 6: Jurkat 세포에서 STAT6 HiBiT 발광 분석을 이용한 AK-1690의 분해 메커니즘 조사
그림 6은 STAT6 HiBiT 발광 분석을 사용하여 Jurkat 세포에서 AK-1690의 분해 메커니즘을 조사한 결과를 보여줍니다. 이 실험은 AK-1690이 STAT6 단백질을 어떻게 분해하는지 그 기전을 설명하는 데 중요한 역할을 합니다.
실험 구성:
- Jurkat 세포는 HiBiT 태그가 부착된 STAT6 단백질을 발현하도록 처리되었습니다.
- 세포들은 AK-1690 (2 μM), AK-068 (20 μM), 레날리도마이드(20 μM), 또는 MLN4294 (0.5 μM) 처리되었으며, 그 후 5분 간격으로 발광 신호를 측정하여 STAT6 단백질 수준의 변화를 추적했습니다.
- 복합 처리 실험에서는 AK-068, 레날리도마이드, MLN4294를 45분 동안 전처리한 후 AK-1690을 추가하여 STAT6 분해의 조절 여부를 확인했습니다.
주요 결과:
- AK-1690의 STAT6 분해:
- AK-1690 (2 μM)는 시간에 따라 발광 신호가 감소하는 것으로 나타났으며, 이는 STAT6 단백질의 감소를 반영합니다. 이 결과는 AK-1690이 STAT6을 효과적으로 분해함을 보여줍니다.
- AK-068과의 복합 처리:
- AK-068은 STAT6에 높은 결합력을 갖지만, 단독으로는 발광 신호를 유의미하게 변화시키지 않았습니다.
- AK-068과 AK-1690을 복합 처리한 경우, AK-068이 AK-1690에 의한 STAT6 분해를 억제하는 효과가 나타났습니다. 이는 AK-068이 STAT6 분해에 필요한 자리를 차지해 AK-1690의 작용을 방해했음을 시사합니다.
- 레날리도마이드와의 상호작용:
- 레날리도마이드는 자체적으로 STAT6 발광 신호에 영향을 미치지 않았지만, AK-1690과 레날리도마이드를 함께 처리했을 때, STAT6 분해가 완전히 차단되었습니다. 이는 AK-1690이 Cereblon을 통해 STAT6을 분해하는 데 레날리도마이드와 경쟁한다는 것을 보여줍니다.
- MLN4294와의 상호작용:
- MLN4294는 E1 neddylation 억제제로, 자체적으로는 STAT6 발광 신호에 영향을 주지 않았습니다.
- 그러나 MLN4294와 AK-1690을 함께 처리한 경우, STAT6 분해가 완전히 차단되었습니다. 이는 AK-1690에 의한 STAT6 분해가 neddylation 과정에 의존한다는 사실을 시사합니다.
결론:
- AK-1690은 STAT6 분해를 유도하는 강력한 PROTAC이며, 그 메커니즘은 Cereblon과의 결합 및 neddylation 과정을 통해 작동합니다.
- AK-068은 STAT6과의 결합을 방해함으로써 AK-1690의 작용을 저해할 수 있습니다.
- 이 실험을 통해 AK-1690이 PROTAC 메커니즘을 통해 STAT6을 효과적으로 분해한다는 것을 명확히 알 수 있으며, 그 작용이 Cereblon 및 neddylation에 의존함을 확인할 수 있었습니다.
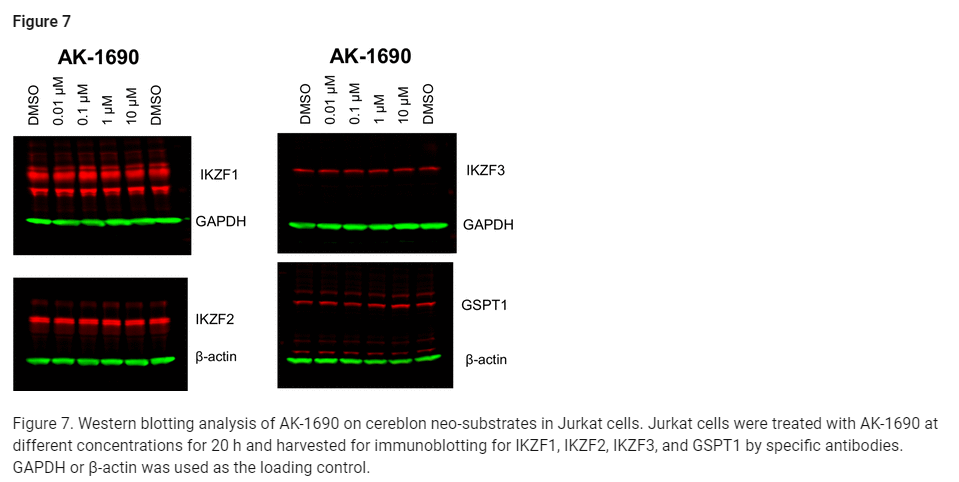
Figure 7: Jurkat 세포에서 Cereblon Neo-Substrates에 대한 AK-1690의 웨스턴 블롯 분석
그림 7은 Jurkat 세포에서 AK-1690이 Cereblon neo-substrates인 IKZF1, IKZF2, IKZF3, GSPT1 단백질에 미치는 영향을 조사한 웨스턴 블롯(Western Blot) 분석 결과를 보여줍니다. 이 실험은 AK-1690이 STAT6 이외에 Cereblon에 의해 표적화되는 다른 단백질들에도 영향을 미치는지 확인하기 위한 실험입니다.
실험 구성:
- Jurkat 세포는 AK-1690으로 20시간 동안 다양한 농도에서 처리되었습니다.
- 처리 후 IKZF1, IKZF2, IKZF3, 그리고 GSPT1 단백질의 수준을 특정 항체를 사용한 면역 블롯(immunoblotting)을 통해 확인했습니다.
- GAPDH 또는 β-actin을 로딩 컨트롤로 사용하여, 각 실험에서 동일한 단백질 양이 사용되었음을 보장했습니다.
주요 결과:
- AK-1690은 20시간 처리 후, IKZF1, IKZF2, IKZF3, GSPT1 단백질 수준에 유의미한 영향을 미치지 않았습니다.
- 이는 AK-1690이 Cereblon을 통한 STAT6 분해에는 영향을 미치지만, IKZF1-3 및 GSPT1과 같은 다른 neo-substrates에는 영향을 주지 않음을 나타냅니다.
- 특히 IKZF1-3은 종종 Cereblon과 관련된 표적 단백질이므로, AK-1690이 이 단백질들에 영향을 주지 않는다는 점은 선택성 면에서 중요한 결과입니다.
결론:
- AK-1690은 STAT6을 선택적으로 분해하며, Cereblon에 의해 표적화되는 다른 단백질들(예: IKZF1, IKZF2, IKZF3, GSPT1)에는 영향을 미치지 않습니다.
- 이 결과는 AK-1690이 STAT6에 대한 높은 선택성을 갖고 있으며, 비표적 단백질에 대한 비특이적 영향을 최소화함을 확인할 수 있었습니다.
- 이러한 선택성은 STAT6 분해제로서의 AK-1690의 효능을 더욱 강조합니다.
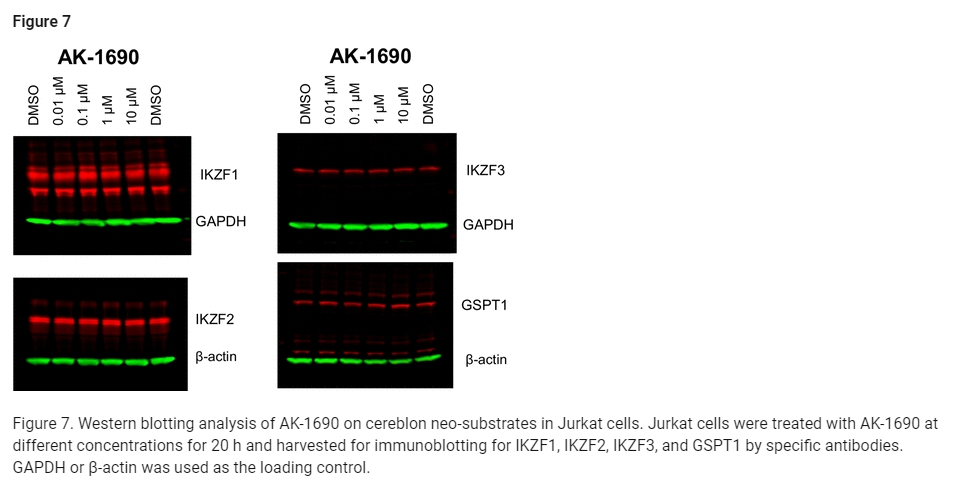
Table 7: Microsomal and Plasma Stability of AK-1690 in Five Different Species
Table 7에서는 AK-1690의 미세소체와 혈장 안정성을 다섯 가지 다른 종(마우스, 랫, 개, 원숭이, 인간)에서 평가한 결과가 제공됩니다. 이 분석은 화합물의 대사와 혈장 내 분해 정도를 파악하기 위해 중요한 데이터를 제공합니다. 이는 약물이 각각의 종에서 얼마나 안정적으로 대사되지 않는지를 확인하고, 인체에서의 잠재적 약물 대사와 배설 경로를 예측하는 데 매우 유용합니다.
내용 설명:
- 미세소체 안정성(Microsomal Stability):
각 종의 간 미세소체에서 AK-1690의 반감기(t1/2)가 측정됩니다. 간 미세소체는 간 내의 대사 효소(CYP450 등)를 포함하고 있어, 미세소체 안정성 테스트는 약물이 대사 효소에 의해 얼마나 빨리 분해되는지 평가합니다. 반감기가 길수록 대사 저항성이 높다는 것을 의미하며, 짧을수록 대사 효소에 의해 빠르게 분해됩니다. - 혈장 안정성(Plasma Stability):
AK-1690이 혈장 내에서 얼마나 안정적으로 유지되는지를 확인하는 실험입니다. 혈장에는 다양한 가수분해 효소가 존재하므로, 이 실험은 약물이 체내에서 가수분해될 가능성을 평가하는 데 중요한 정보를 제공합니다.
결과 해석:
- 각 종에서 AK-1690의 반감기가 다르게 나타납니다. 예를 들어, 인간의 미세소체에서 반감기가 길다면, 이는 인간에서 약물이 대사에 더 저항성이 있어 장기간 혈중에 남을 수 있음을 시사합니다. 반대로, 특정 동물에서 반감기가 짧다면 그 동물에서 약물이 빠르게 대사될 수 있음을 의미합니다.
- 미세소체 및 혈장 안정성 데이터는 신약 개발 초기 단계에서 매우 중요하며, 특히 약물의 안전성과 효능을 예측하고 인간 임상시험으로 넘어가기 전에 종간 차이를 분석하는 데 유용합니다.
이 데이터를 바탕으로 AK-1690이 인간과 비슷한 대사 프로파일을 보이는 동물을 선택해 전임상 시험에서 사용할 수 있습니다.
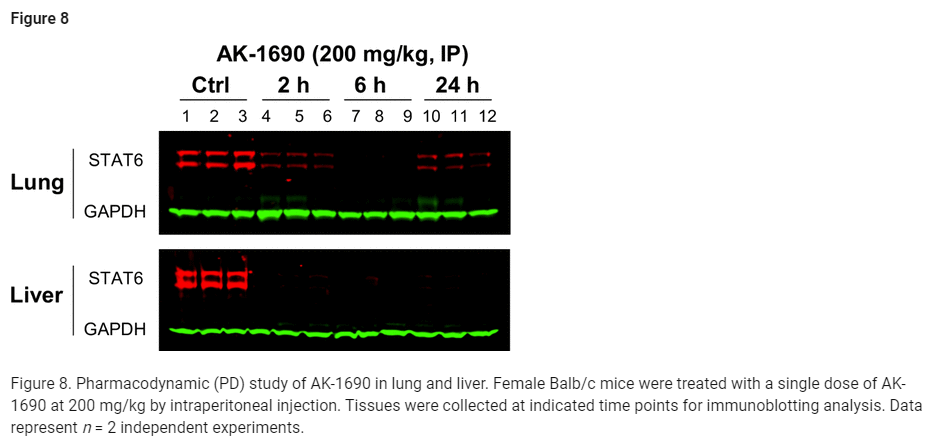
Figure 8: AK-1690의 폐 및 간에서의 약력학(PD) 연구
Figure 8은 AK-1690의 in vivo 약력학적 효과를 평가한 결과입니다. 실험에서는 Balb/c 암컷 마우스에게 200 mg/kg의 AK-1690을 복강 주사로 투여한 후, 폐와 간 조직에서 STAT6 단백질의 변화를 면역 블롯(immunoblotting)을 통해 분석하였습니다.
실험 세부사항:
- 마우스는 AK-1690을 단회 투여 받았으며, 2시간, 6시간, 24시간 후에 조직 샘플을 채취하였습니다.
- 각 시간대에서 조직 내 STAT6 단백질의 수준을 면역 블롯으로 분석하여 AK-1690의 STAT6 분해 효과를 평가했습니다.
주요 결과:
- 간 조직에서의 효과:
- 2시간, 6시간, 24시간 동안 모두 간에서 STAT6 단백질의 90% 이상이 분해되었습니다.
- 폐 조직에서의 효과:
- 폐 조직에서도 AK-1690은 2시간 동안 70%, 6시간 동안 90%, 그리고 24시간 동안 70%의 STAT6 단백질을 분해했습니다.
결론:
- AK-1690은 in vivo 실험에서 폐와 간 조직에서 STAT6 단백질을 효과적으로 분해하는 능력을 입증했습니다.
- 약물 투여 후 24시간 동안 STAT6이 지속적으로 분해되었으며, 이는 AK-1690의 장기적인 분해 효과와 생체 내 약물 효능을 나타냅니다.
Summary:
STAT6은 다양한 질병 치료를 위한 잠재적 타겟으로 연구되었으나, 강력하고 선택적인 STAT6 억제제의 개발은 지난 20년간 지체되었습니다. 본 연구에서는 PROTAC 기술을 사용하여 첫 번째 강력하고 선택적인 STAT6 분해제인 AK-1690을 개발하였습니다.
처음에 Ki = 3.5 μM의 결합력을 가진 STAT6 리간드(화합물 1)에서 시작해 구조 기반 설계를 통해 AK-068을 발견하였으며, 이 리간드는 Ki = 6 nM의 결합력을 가지며, STAT5A 및 STAT5B에 비해 각각 150배, 85배 이상 선택적인 특성을 보였습니다.
AK-068과 Cereblon 리간드를 결합하고, 연결부 및 연결 위치를 최적화하여 AK-1690을 디자인하였습니다. AK-1690은 MV4;11 백혈병 세포주에서 DC50 = 1 nM으로 STAT6 단백질을 효과적으로 분해하였으며, 다른 STAT 단백질에는 거의 영향을 미치지 않았습니다. PBMC 세포에서는 DC50 = 80 nM과 Dmax > 90%의 STAT6 분해 효과를 보였으며, 다른 STAT 단백질에는 영향을 주지 않았습니다. 또한, L1236 림프종 세포주에서는 AK-1690이 STAT6 및 인산화 STAT6을 분해하는 데 성공했으나, AK-068은 인산화 STAT6을 억제하지 못했습니다.
프로테오믹스 분석에서는 AK-1690이 18시간 동안 79%의 STAT6을 분해했으며, 6,000개의 다른 단백질에는 유의미한 영향을 주지 않았습니다. 미세소체 및 혈장 안정성 실험에서는 AK-1690이 우수한 안정성을 보여 in vivo 연구에 적합한 도구 화합물로 평가되었습니다. 마우스에서 AK-1690은 폐 및 간에서 STAT6을 효과적으로 분해하였으며, 히스타민 유도 저혈량증을 완화하는 데 기여했습니다.
따라서, AK-1690은 STAT6을 타겟으로 한 신약 개발의 유망한 후보물질로 평가됩니다.
더 자세한 세부 내용은 Journal of Medicinal Chemistry, September 23, 2024. DOI: 10.1021/acs.jmedchem.4c01009 에서 찾아 보시기 바랍니다.
'Company > Journals' 카테고리의 다른 글
| 🌿 간신증후군 치료를 위한 고효율 천연 항산화제 스크리닝과 형광 탐지 기술 🌿 (1) | 2024.09.23 |
|---|
