이 논문의 연구내용은 PROTAC(Proteolysis-Targeting Chimera)라는 단백질 분해 기술을 활용하여 기존의 약물로는 타겟팅하기 어려운 단백질을 선택적으로 제거하는 방법에 대한 내용을 다룹니다. PROTAC은 목표 단백질과 E3 리가아제를 연결하여 단백질을 유비퀴틴-프로테아좀 시스템으로 유도하고 분해합니다. 연구의 주요 초점은 삼원 복합체의 형성과 분해를 이해하는 데 있으며, 특히 E3 리가아제와 목표 단백질 간의 상호작용, 결합 역학, 선택성, 링크 길이, 그리고 PROTAC의 구조적 변화에 중점을 둡니다.
주요 내용 요약:
- PROTAC의 혁신성과 장점: PROTAC은 기존의 소분자 억제제와 다르게 타겟팅 유연성, 높은 효능, 선택성, 지속적인 분해 효과 등의 이점을 가지고 있습니다. 특히 저친화성 리간드와도 효과적으로 작동할 수 있어 'undruggable' 단백질을 표적할 수 있습니다.
- E3 리가아제와 목표 단백질 간의 상호작용: 이 연구에서는 다양한 E3 리가아제(VHL, CRBN, cIAP)와 목표 단백질 간의 상호작용을 분석하였습니다. VHL은 가장 많이 사용되는 E3 리가아제로, BRD4, WDR5, SMARCA2/4 등의 단백질과 결합하여 PROTAC 기반 분해를 유도합니다. 각 단백질-리가아제 복합체의 결합 방식과 링크 길이에 따라 형성되는 3D 구조가 달라지는 것이 관찰되었습니다.
- 링커 디자인의 중요성: PROTAC의 링커 길이와 구조는 삼원 복합체의 안정성과 효율성에 중요한 역할을 합니다. 예를 들어, 짧은 링커는 타겟 단백질과 E3 리가아제 간의 더 강한 상호작용을 촉진하며, 더 긴 링커는 더 유연한 구조를 허용하지만 복합체의 안정성을 저하시킬 수 있습니다.
- 분자 동역학(MD) 시뮬레이션: 연구는 분자 동역학 시뮬레이션을 통해 다양한 PROTAC 삼원 복합체의 안정성과 동작을 평가했습니다. 각 복합체는 시뮬레이션 동안 상호작용 패턴을 유지했으며, 특히 BRD4-BD1/BD2와 VHL 복합체가 매우 안정적임을 확인했습니다.
- PROTAC의 실험적 활동과 일치하는 구조적 특징: 시뮬레이션 결과는 PROTAC이 실험적으로 관찰된 분해 효과와 일치하는 구조적 특징을 가지고 있음을 보여주었습니다. 예를 들어, 특정 PROTAC은 단백질 간의 상호작용을 더 잘 유지하는 구조적 특징을 가지고 있어 더 강한 분해 효과를 나타냅니다.
- 결론: 이 연구는 PROTAC 설계에서 삼원 복합체의 형성과 안정성을 이해하는 것이 중요하다는 것을 강조합니다. 이를 통해 질병 유발 단백질을 표적하는 새로운 치료제를 개발하는 데 기여할 수 있으며, 앞으로의 연구에서는 이러한 삼원 복합체의 구조적 특성을 보다 정밀하게 이해하는 것이 필요합니다.

1. Ubiquitination 및 Proteasome 경로
- 설명: 이 부분은 PROTAC이 작동하는 일반적인 메커니즘을 보여줍니다.
- E1, E2, E3: 유비퀴틴-프로테아좀 시스템에서 E1은 유비퀴틴 활성화 효소, E2는 유비퀴틴 연결 효소, E3는 유비퀴틴 리가아제로 역할을 합니다.
- PROTAC 메커니즘: PROTAC은 타겟 단백질과 E3 리가아제를 물리적으로 연결합니다. E3 리가아제는 타겟 단백질에 유비퀴틴을 붙여 프로테아좀에 의해 분해되도록 유도합니다.
- 프로테아좀: 유비퀴틴화된 단백질을 분해하는 복합체입니다. 분해된 단백질은 펩타이드로 변환됩니다.
2. Cooperativity (협력성)
- 설명: 협력성(cooperativity)은 PROTAC이 삼원 복합체를 형성할 때 타겟 단백질과 E3 리가아제가 상호작용하여 안정성을 증가시키는 것을 의미합니다.
- 협력성 구조: 그림에서 협력성을 보여주는 구조는 두 단백질(오렌지색과 보라색) 사이의 상호작용을 시각화합니다. 이러한 상호작용은 PROTAC의 효능을 증가시키는 데 중요한 역할을 합니다.
- 화학 구조: 이 구조는 PROTAC 분자가 어떻게 두 단백질을 연결하는지를 보여줍니다.
3. Selectivity (선택성)
- 설명: 선택성은 PROTAC이 특정 단백질을 목표로 삼아 분해할 수 있는 능력을 의미합니다.
- 선택적 결합: 이 그림에서는 PROTAC이 특정 잔기(예: Glu1669, Leu1545)에 결합하는 모습을 보여줍니다. 이 선택적 결합은 PROTAC이 타겟 단백질을 정확하게 식별하고 결합하는 능력을 시사합니다.
- 선택적 타겟팅: PROTAC이 타겟 단백질과 E3 리가아제를 선택적으로 결합하도록 설계된 분자의 중요성을 강조합니다.
4. PROTAC-induced Ternary Complex (PROTAC에 의해 유도된 삼원 복합체)
- 설명: 이 그림은 PROTAC이 목표 단백질과 E3 리가아제를 연결하여 형성된 삼원 복합체를 보여줍니다.
- 삼원 복합체 형성: 보라색, 청록색, 그리고 파란색 구조로 표현된 단백질들이 PROTAC에 의해 서로 결합하여 삼원 복합체를 형성하는 모습입니다. 이 복합체는 목표 단백질이 유비퀴틴화되어 분해되도록 유도합니다.
- PROTAC 위치: 가운데에 위치한 PROTAC 분자가 두 단백질을 물리적으로 연결하여 복합체를 형성하는 핵심 역할을 합니다.
5. Linker Design (링커 디자인)
- 설명: 링커는 PROTAC의 두 중요한 결합 도메인을 물리적으로 연결하는 부분입니다.
- 링커 구조: 이 그림에서는 링커가 어떻게 설계되었는지, 그리고 어떻게 단백질 간의 결합을 최적화하는지 보여줍니다.
- 링커의 중요성: 링커 길이와 유연성은 삼원 복합체의 안정성과 결합 효율성을 크게 좌우합니다. 적절한 링커 설계는 PROTAC의 전반적인 기능을 크게 향상시킬 수 있습니다.

위의 각 차트는 각각 목표 단백질(Targeted Proteins), E3 리가아제(E3-Ligases), 그리고 링커(Linkers)의 사용 빈도와 분포를 보여줍니다.
1. (a) Targeted Proteins - 목표 단백질
- 설명: 이 차트는 PROTAC 연구에서 타겟으로 삼은 단백질들을 분포로 보여줍니다. 각 섹터는 특정 단백질이 얼마나 많이 연구되었는지를 나타내며, 해당 단백질과 관련된 PROTAC 복합체 수를 함께 표시합니다.
- BRD4-BD1 (8): 가장 많이 연구된 목표 단백질로, 전체에서 큰 비중을 차지하고 있습니다. BRD4는 염색질 리모델링에 중요한 역할을 하며, 특히 암 연구에서 중요한 타겟입니다.
- SMARCA4 (2)와 SMARCA2 (7): 이 단백질들은 SWI/SNF 염색질 리모델링 복합체의 중요한 구성 요소로, 유전자 발현 조절에 관여합니다.
- WDR5 (7): 염색질 리모델링 및 전사 조절에서 중요한 역할을 하는 단백질로, PROTAC 타겟으로 많이 연구되었습니다.
- BCL-XL (1), BTK (3), FAK (1), FKBP51 (1): 각각 다른 질병과 관련된 단백질들로, 특정 질환에서 PROTAC의 타겟으로 사용됩니다.
- KRAS (3): 암 유발 단백질로, 특히 'undruggable'로 분류된 타겟이지만 PROTAC 연구에서 중요한 역할을 하고 있습니다.
2. (b) E3 Ligases - E3 리가아제
- 설명: 이 차트는 PROTAC 설계에서 사용된 E3 리가아제의 분포를 보여줍니다. E3 리가아제는 단백질을 유비퀴틴화하여 프로테아좀에 의해 분해되도록 하는 역할을 합니다.
- VHL (30): Von Hippel–Lindau 단백질이 가장 많이 사용된 E3 리가아제입니다. VHL은 다양한 단백질과 강한 상호작용을 형성할 수 있는 유연성이 있습니다.
- CRBN (5): Cereblon은 또 다른 주요 E3 리가아제로, 특정 질병 타겟에서 중요하게 사용됩니다.
- cIAP (3): Cellular Inhibitor of Apoptosis Protein으로, 세포 사멸 억제와 관련된 E3 리가아제입니다.
3. (c) Linkers - 링커
- 설명: 이 차트는 PROTAC에서 사용된 링커의 유형을 보여줍니다. 링커는 PROTAC의 두 결합 부위를 물리적으로 연결하여 삼원 복합체의 형성 및 안정성에 중요한 역할을 합니다.
- Alkyl (13): 알킬 링크는 PROTAC에서 가장 많이 사용된 링커 유형으로, 짧고 유연성이 적지만 강한 결합을 형성할 수 있습니다.
- PEG (12): Polyethylene Glycol 링크는 비교적 긴 사슬을 가지며, 높은 유연성과 용해도를 제공하여 PROTAC의 안정성을 높이는 데 기여합니다.
- Rigid (8): 강직한 구조의 링크는 특정 단백질 간의 결합을 더 강하게 할 수 있으며, 결합 부위의 정확한 정렬을 돕습니다.
- Mixed (5): 혼합형 링크는 다양한 성질을 결합하여 특정 요구에 맞게 설계된 링커입니다.
PROTAC 연구에서 어떤 요소들이 주로 사용되고 있는지를 명확히 보여줍니다. BRD4-BD1과 VHL이 각각 목표 단백질과 E3 리가아제로 가장 많이 연구되고 있으며, 알킬과 PEG 링크가 주로 사용된다는 것을 확인할 수 있습니다. 이러한 정보는 PROTAC 설계 및 최적화에서 중요한 참고 자료가 됩니다. 연구자들은 이 데이터를 바탕으로 특정 타겟과 결합이 최적화된 PROTAC을 설계할 수 있습니다.
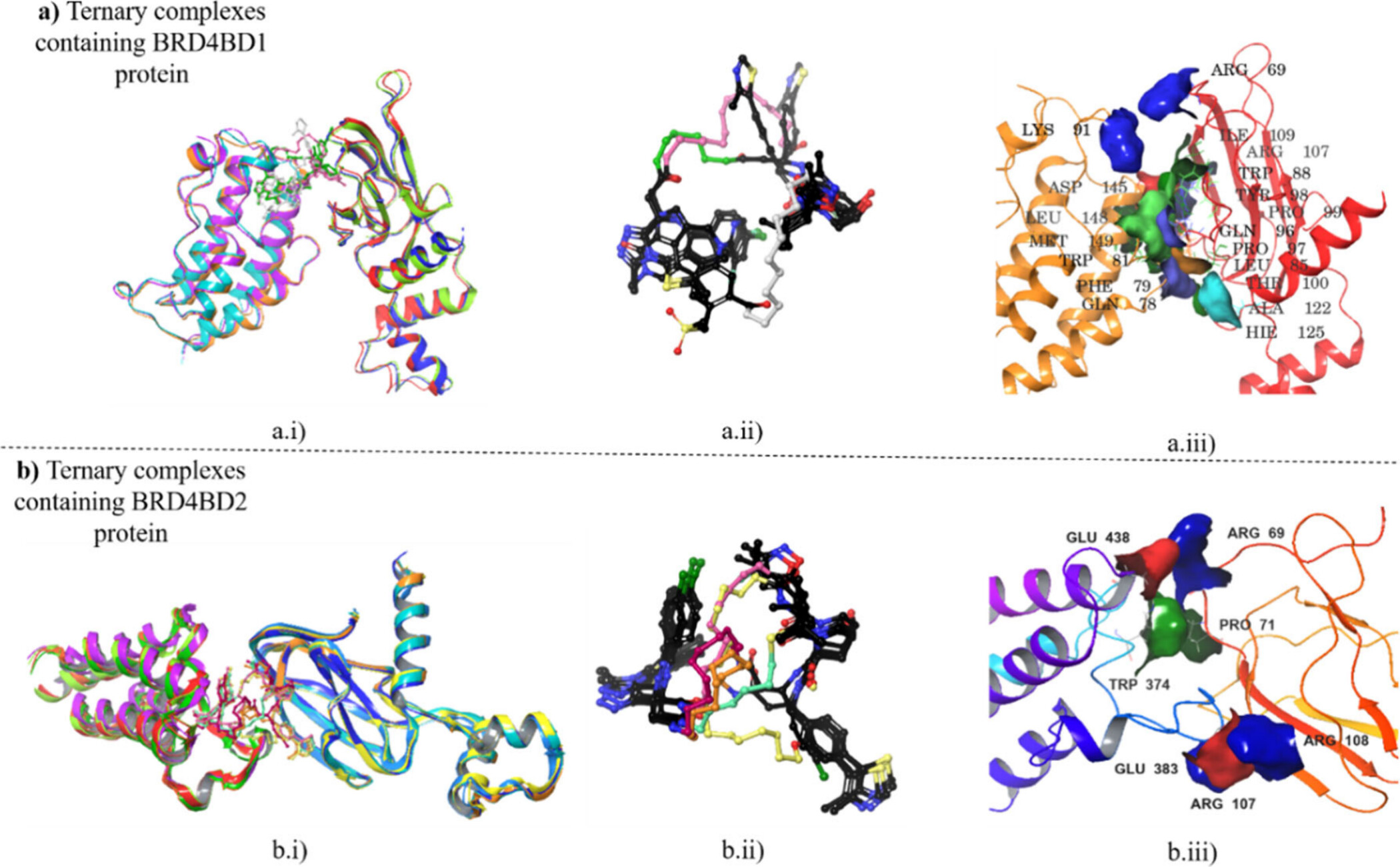
a) BRD4-BD1 단백질을 포함하는 삼원 복합체
a.i) 삼원 복합체 정렬
- 설명: 이 그림은 BRD4-BD1과 VHL이 다양한 PROTAC 분자를 통해 삼원 복합체를 형성한 후의 구조적 정렬을 보여줍니다.
- 매디캠적 분석: BRD4-BD1은 브로모도메인으로, 염색질에서 아세틸화된 히스톤을 인식하고 결합하는 역할을 합니다. 다양한 PROTAC이 BRD4-BD1과 VHL을 연결하여 안정적인 삼원 복합체를 형성하는데, 이 과정에서 각 복합체가 어떻게 정렬되고 구조적으로 유지되는지를 시각적으로 확인할 수 있습니다. 이 정렬은 복합체의 안정성과 타겟 단백질의 효율적인 분해를 위한 중요한 요소입니다.
a.ii) 링커 구조
- 설명: 이 그림은 BRD4-BD1과 VHL을 연결하는 PROTAC 분자의 링커 부분입니다.
- 매디캠적 분석: PROTAC의 링커는 목표 단백질(BRD4-BD1)과 E3 리가아제(VHL) 사이의 물리적 결합을 유지하는 중요한 역할을 합니다. 이 그림에서는 다양한 PROTAC의 링커가 어떻게 설계되었는지, 그리고 그 구조적 차이가 복합체의 결합 안정성에 어떻게 영향을 미치는지를 보여줍니다. 적절한 링커 설계는 삼원 복합체의 형성과 유지에 매우 중요하며, 이를 통해 PROTAC의 효능을 최적화할 수 있습니다.
a.iii) 상호작용 잔기들
- 설명: 이 그림은 BRD4-BD1과 VHL 사이에서 결합에 중요한 역할을 하는 아미노산 잔기들을 보여줍니다.
- 매디캠적 분석: 특정 아미노산 잔기(예: ARG, GLU, PRO)가 BRD4-BD1과 VHL 간의 상호작용에서 중요한 역할을 합니다. 이러한 잔기들은 단백질-단백질 결합의 안정성을 높이는 데 필수적입니다. 이 상호작용을 이해함으로써, 연구자들은 PROTAC이 특정 결합 부위에서 어떻게 작용하는지, 그리고 이를 통해 단백질 분해가 어떻게 촉진되는지를 알 수 있습니다.
b) BRD4-BD2 단백질을 포함하는 삼원 복합체
b.i) 삼원 복합체 정렬
- 설명: 이 그림은 BRD4-BD2와 VHL이 다양한 PROTAC을 통해 삼원 복합체를 형성한 후의 구조적 정렬을 보여줍니다.
- 매디캠적 분석: BRD4-BD2도 BRD4-BD1과 유사하게 염색질에서 중요한 역할을 하는 브로모도메인입니다. 그러나 이 도메인은 약간 다른 구조적 특성을 가지며, 이로 인해 VHL과의 결합이 다르게 나타날 수 있습니다. 이 정렬은 BRD4-BD1과 유사하지만, 미세한 구조적 차이가 있을 수 있으며, 이는 복합체의 안정성 및 기능에 영향을 줄 수 있습니다.
b.ii) 링커 구조
- 설명: 이 그림은 BRD4-BD2와 VHL을 연결하는 PROTAC 링커 부분을 강조합니다.
- 매디캠적 분석: BRD4-BD2의 경우에도 링커의 설계는 복합체의 안정성에 중요한 영향을 미칩니다. 이 그림은 BRD4-BD2와 VHL 사이에 사용된 다양한 링커 구조를 보여주며, 이들이 복합체의 물리적 특성에 어떻게 기여하는지 설명합니다. 최적의 링커 설계를 통해, 삼원 복합체의 효과적인 형성과 단백질 분해를 촉진할 수 있습니다.
b.iii) 상호작용 잔기들
- 설명: 이 그림은 BRD4-BD2와 VHL 사이의 결합을 돕는 중요한 아미노산 잔기들을 보여줍니다.
- 매디캠적 분석: BRD4-BD2와 VHL 사이의 상호작용은 BRD4-BD1과 유사하지만, 특정 잔기들(예: GLU, ARG)이 다른 위치에 있을 수 있습니다. 이러한 차이는 결합의 특성과 복합체의 안정성에 영향을 미칠 수 있으며, 이를 통해 PROTAC의 선택적 결합과 효능을 이해할 수 있습니다.
종합 설명:
이 이미지에서 BRD4-BD1과 BRD4-BD2가 VHL과 함께 형성하는 삼원 복합체의 구조적 분석은, PROTAC 설계에서 중요한 요소들을 이해하는 데 필수적입니다. 단백질 간의 정렬, 링커 설계, 그리고 상호작용 잔기들의 분석을 통해 연구자들은 더 효과적이고 안정적인 PROTAC을 설계할 수 있으며, 이를 통해 특정 단백질 타겟에 대한 효능을 극대화할 수 있습니다. 이러한 구조적 이해는 새로운 치료제 개발에 중요한 기초가 됩니다.
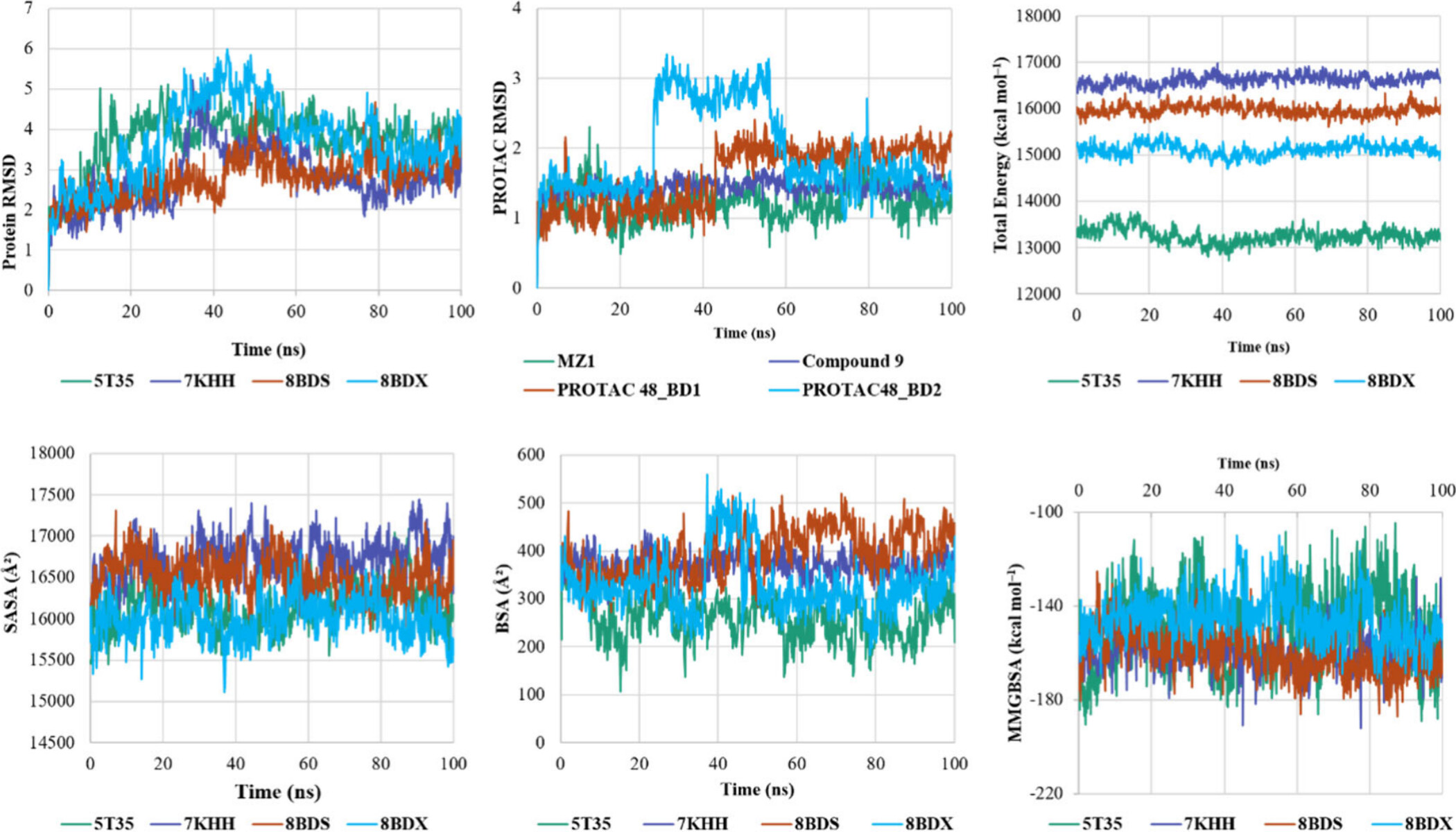
위의 각 그래프는 BRD4-BD1/BD2 단백질과 VHL E3 리가아제가 결합하여 형성된 삼원 복합체의 동역학적 안정성과 관련된 여러 매개변수를 시뮬레이션한 결과를 보여줍니다. 각 그래프는 시뮬레이션 시간(나노초, ns)에 따른 다양한 물리적 특성을 추적합니다. 아래에서 각 그래프를 설명하겠습니다.
1. Protein RMSD (Root Mean Square Deviation)
- 그래프 설명: 이 그래프는 시뮬레이션 동안 단백질의 RMSD 값을 나타냅니다. RMSD는 단백질 구조가 시간에 따라 얼마나 변화했는지를 나타내며, 구조적 안정성을 평가하는 데 사용됩니다.
- 분석: 5T35, 7KHH, 8BDS, 8BDX의 네 가지 삼원 복합체 중에서, 8BDX (하늘색)가 가장 큰 RMSD 변동을 보이고 있습니다. 이는 이 복합체가 시뮬레이션 동안 더 큰 구조적 변화를 겪었음을 나타냅니다. 반면에, 7KHH (보라색)와 8BDS (주황색)는 상대적으로 더 낮은 RMSD 값을 유지하며, 더 안정적인 구조를 나타냅니다.
2. PROTAC RMSD
- 그래프 설명: 이 그래프는 시뮬레이션 동안 PROTAC의 RMSD 값을 보여줍니다. PROTAC의 RMSD는 PROTAC 분자가 삼원 복합체에서 어떻게 안정적으로 결합하고 있는지를 나타냅니다.
- 분석: 그래프에서 PROTAC 48_BD1 (주황색)과 PROTAC 48_BD2 (하늘색)의 RMSD가 비교적 높게 나타나는 것을 볼 수 있습니다. 이는 이들 PROTAC이 결합된 삼원 복합체에서 구조적으로 덜 안정적일 수 있음을 시사합니다. MZ1 (녹색)과 Compound 9 (보라색)는 상대적으로 낮은 RMSD 값을 유지하고 있어 더 안정적인 결합을 나타냅니다.
3. Total Energy
- 그래프 설명: 이 그래프는 시뮬레이션 동안 삼원 복합체의 총 에너지를 나타냅니다. 총 에너지는 시스템의 전체적인 안정성을 평가하는 지표입니다.
- 분석: 5T35 (녹색) 복합체는 다른 복합체들에 비해 총 에너지가 낮게 유지되고 있어, 가장 안정적일 가능성이 큽니다. 반면에 8BDX (하늘색) 복합체는 에너지가 더 높아 비교적 덜 안정적일 수 있음을 나타냅니다.
4. SASA (Solvent Accessible Surface Area)
- 그래프 설명: 이 그래프는 시뮬레이션 동안 삼원 복합체의 용매 접근 가능 표면적(SASA)을 나타냅니다. SASA는 단백질의 표면 중 용매에 노출된 부분을 의미하며, 단백질-단백질 상호작용의 강도를 간접적으로 측정할 수 있습니다.
- 분석: 모든 복합체에서 SASA 값이 시간이 지나면서 크게 변하지 않는 것을 볼 수 있습니다. 그러나 7KHH (보라색) 복합체가 더 높은 SASA 값을 보여주고 있어, 이 복합체가 다른 것들에 비해 더 많이 용매에 노출되어 있음을 시사합니다.
5. BSA (Buried Surface Area)
- 그래프 설명: 이 그래프는 삼원 복합체의 매몰 표면적(BSA)을 나타냅니다. BSA는 단백질 간 결합에 의해 내부에 매몰된 표면적을 의미하며, 단백질-단백질 결합 강도의 중요한 지표입니다.
- 분석: 7KHH (보라색)와 8BDX (하늘색) 복합체는 더 높은 BSA 값을 유지하고 있어, 이들 복합체가 더 강한 단백질-단백질 결합을 가지고 있음을 나타냅니다. 반면에, 5T35 (녹색) 복합체는 상대적으로 더 낮은 BSA 값을 보입니다.
6. MMGBSA (Molecular Mechanics Generalized Born Surface Area)
- 그래프 설명: 이 그래프는 시뮬레이션 동안 삼원 복합체의 MMGBSA 에너지를 나타냅니다. MMGBSA는 결합 자유 에너지를 예측하는 데 사용되며, 복합체의 안정성을 평가합니다.
- 분석: MMGBSA 값이 낮을수록 더 안정적인 결합을 의미합니다. 8BDX (하늘색) 복합체가 가장 낮은 MMGBSA 값을 유지하고 있어, 이 복합체가 더 안정적인 결합을 형성할 수 있음을 나타냅니다. 반면에, 7KHH (보라색) 복합체는 상대적으로 높은 값을 유지하고 있습니다.
각 그래프는 다양한 삼원 복합체의 안정성과 결합 특성을 다양한 측면에서 평가하고,각 시뮬레이션에서 RMSD, 에너지, SASA, BSA, 그리고 MMGBSA 분석을 통해 삼원 복합체의 구조적 안정성을 이해할 수 있으며, 이 정보를 바탕으로 PROTAC의 최적화 방향을 결정할 수 있습니다. PROTAC 설계 시 이러한 데이터를 활용하여 더 안정적이고 효과적인 약물 후보를 개발할 수 있습니다.
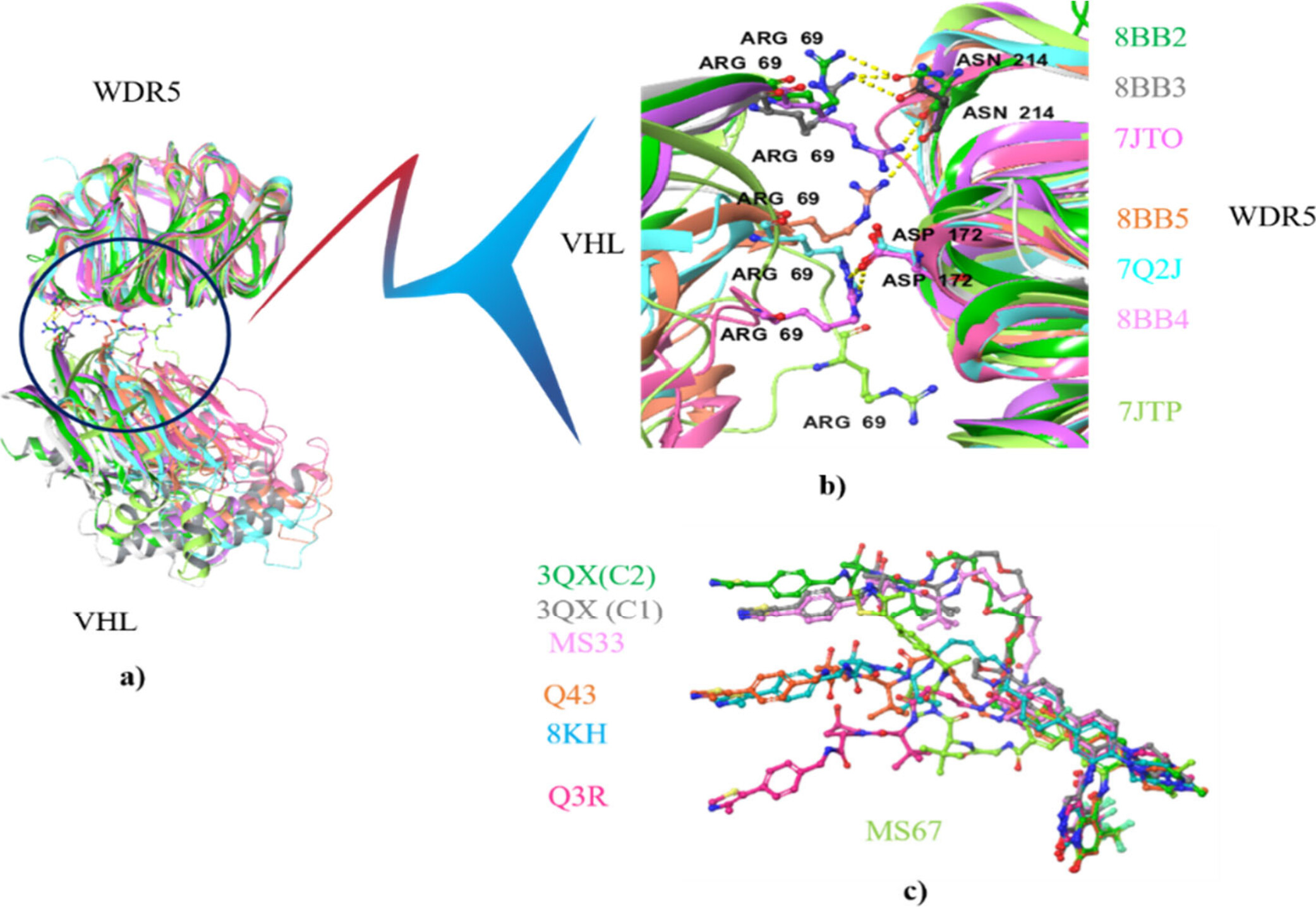
위 그림은 WDR5와 VHL 단백질 간의 상호작용을 중심으로, PROTAC이 이 두 단백질을 어떻게 연결하고 삼원 복합체를 형성하는지를 시각적으로 나타내고 있습니다. 각 부분을 매디캠적 관점에서 설명하겠습니다.
a) WDR5와 VHL의 삼원 복합체 정렬
- 설명: 이 부분은 WDR5와 VHL 단백질이 여러 PROTAC에 의해 삼원 복합체를 형성했을 때의 구조적 정렬을 보여줍니다.
- 매디캠적 분석: WDR5는 염색질 리모델링에 중요한 역할을 하는 단백질로, 유전자 발현 조절에 필수적입니다. VHL은 유비퀴틴-프로테아좀 경로에서 작용하는 E3 리가아제입니다. 이 두 단백질이 PROTAC에 의해 물리적으로 연결되면, WDR5가 유비퀴틴화되어 분해됩니다. 이 그림에서 다양한 삼원 복합체의 구조가 중첩된 상태로 나타나며, 이를 통해 각각의 복합체가 어떻게 정렬되고 있는지, 그리고 그 안정성에 대해 시사하는 바를 알 수 있습니다.
b) 상호작용 잔기들
- 설명: 이 부분은 WDR5와 VHL 사이에서 결합을 돕는 중요한 아미노산 잔기들을 확대하여 보여줍니다. 특히, 아르지닌(Arg69), 아스파라긴(Asn214), 아스파르트산(Asp172)과 같은 잔기들이 강조됩니다.
- 매디캠적 분석: 특정 아미노산 잔기들은 단백질-단백질 결합의 강도와 안정성을 결정짓는 중요한 역할을 합니다. 예를 들어, Arg69는 VHL과 WDR5 사이에서 강력한 상호작용을 형성하는 데 핵심적인 역할을 합니다. 이러한 상호작용은 삼원 복합체의 형성을 촉진하며, PROTAC의 효율적인 작용을 가능하게 합니다. 이 그림은 PROTAC이 결합된 상태에서 두 단백질이 어떻게 상호작용하는지를 상세히 보여주며, 특정 잔기들의 위치와 그 역할을 시각적으로 강조합니다.
c) 링커 구조
- 설명: 이 부분은 PROTAC의 링커 부분을 강조하며, 다양한 PROTAC들이 WDR5와 VHL 사이에서 어떻게 결합을 형성하는지 보여줍니다.
- 매디캠적 분석: PROTAC의 링커는 두 단백질을 연결하는 물리적 다리 역할을 하며, 삼원 복합체의 안정성을 좌우합니다. 여기서 다양한 PROTAC이 사용된 것을 볼 수 있으며, 각 PROTAC의 링커가 어떻게 설계되었고, 그 구조적 차이가 결합에 어떤 영향을 미치는지를 보여줍니다. 예를 들어, 특정 PROTAC은 짧은 알킬 사슬을 사용하여 단단한 결합을 형성하는 반면, 다른 PROTAC은 유연성이 높은 PEG 링크를 사용하여 복합체의 유연성을 증가시킬 수 있습니다. 이 정보는 PROTAC의 효능을 최적화하기 위한 링커 디자인에 중요한 인사이트를 제공합니다.
WDR5와 VHL 사이의 삼원 복합체 형성과 관련된 구조적 특성을 시각적으로 분석하였으며, 각 단백질 간의 상호작용 잔기와 PROTAC 링커의 설계를 이해함으로써, 연구자들은 더 효과적이고 안정적인 PROTAC을 설계할 수 있습니다. 이 구조적 분석은 PROTAC이 단백질을 타겟팅하고 분해하는 데 있어 핵심적인 역할을 하며, 새로운 치료제 개발에 중요한 기초 자료로 활용될 수 있습니다.
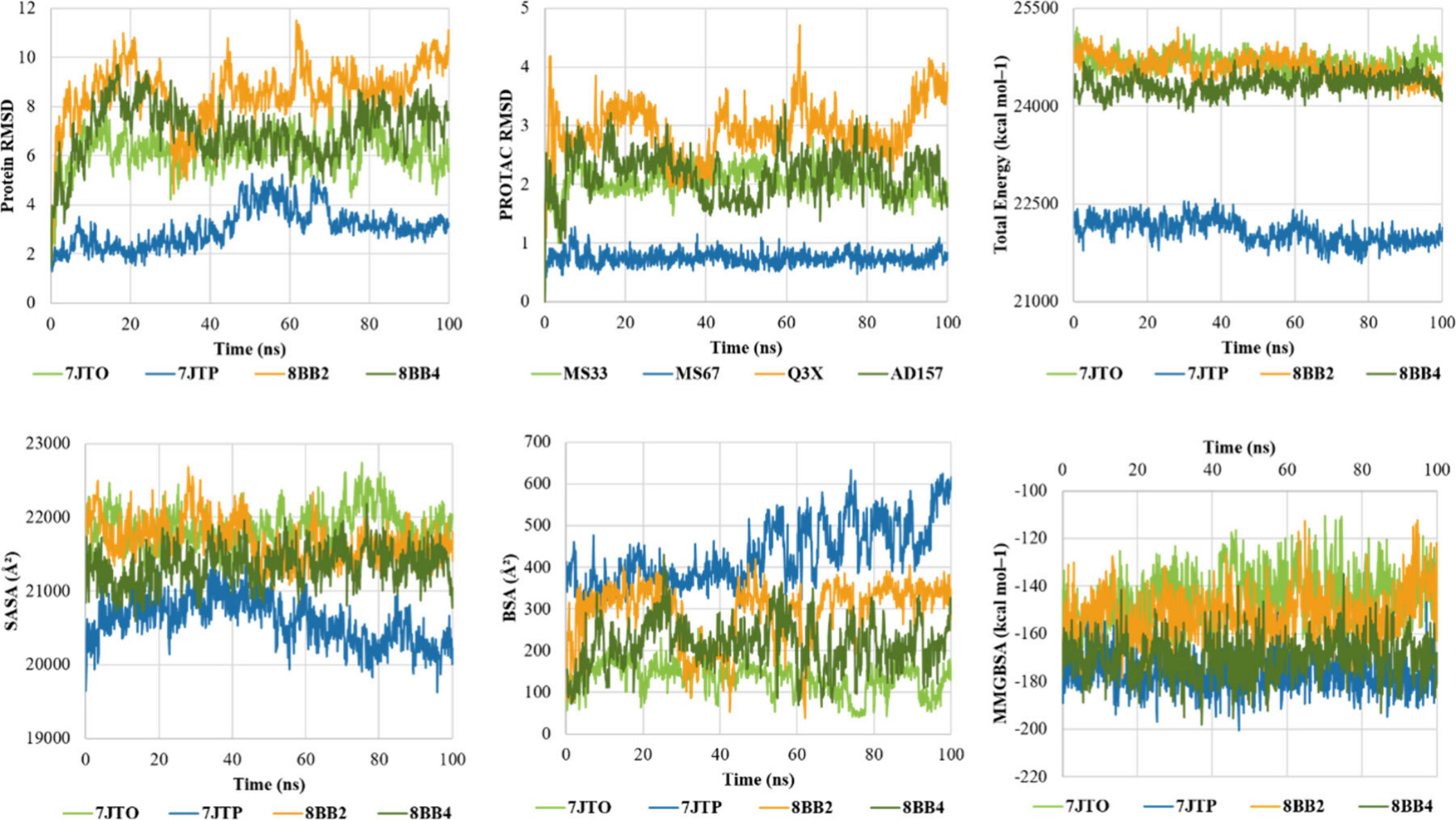
각각의 그래프는 시뮬레이션 시간(나노초, ns)에 따른 여러 물리적 매개변수의 변화를 나타냅니다. 이 데이터를 통해 삼원 복합체의 안정성을 평가할 수 있습니다.
1. Protein RMSD (Root Mean Square Deviation)
- 설명: 이 그래프는 시뮬레이션 동안 각 단백질의 RMSD를 보여줍니다. RMSD는 단백질의 구조가 초기 위치에서 얼마나 벗어나는지를 측정하는 값으로, 구조적 안정성을 평가하는 데 사용됩니다.
- 분석: 7JTO (녹색)와 8BB2 (주황색) 복합체는 RMSD 값이 10 이상으로 증가하면서 비교적 높은 변동성을 보입니다. 반면에 7JTP (파란색) 복합체는 4 이하의 RMSD 값을 유지하며 가장 안정적임을 나타냅니다. 이는 7JTP 복합체가 시뮬레이션 중에 구조적으로 더 안정적이라는 것을 의미합니다.
2. PROTAC RMSD
- 설명: 이 그래프는 시뮬레이션 동안 PROTAC 분자의 RMSD를 보여줍니다. PROTAC의 RMSD는 삼원 복합체에서 PROTAC 분자가 어떻게 안정적으로 결합하고 있는지를 나타냅니다.
- 분석: 7JTP (파란색) 복합체는 PROTAC RMSD 값이 가장 낮고 안정적이며, 8BB2 (주황색)와 8BB4 (녹색)는 더 큰 변동성을 보입니다. 특히 8BB2 복합체는 시뮬레이션 후반에 RMSD 값이 크게 증가하는 것을 볼 수 있습니다. 이는 PROTAC이 결합된 상태에서 더 큰 구조적 변화를 겪었음을 시사합니다.
3. Total Energy
- 설명: 이 그래프는 시뮬레이션 동안 삼원 복합체의 총 에너지를 나타냅니다. 총 에너지는 시스템의 전체적인 안정성을 평가하는 지표로 사용됩니다.
- 분석: 7JTP (파란색) 복합체는 가장 낮은 총 에너지를 유지하며, 8BB2 (주황색)와 8BB4 (녹색) 복합체는 더 높은 에너지를 유지합니다. 총 에너지가 낮을수록 복합체의 안정성이 높다는 것을 의미하므로, 7JTP 복합체가 가장 안정적임을 알 수 있습니다.
4. SASA (Solvent Accessible Surface Area)
- 설명: 이 그래프는 삼원 복합체의 용매 접근 가능 표면적(SASA)을 나타냅니다. SASA는 단백질 표면 중 용매에 노출된 부분을 의미하며, 단백질 간 상호작용의 강도를 간접적으로 측정할 수 있습니다.
- 분석: 모든 복합체에서 SASA 값이 크게 변하지 않지만, 7JTP (파란색) 복합체는 다른 복합체들에 비해 더 낮은 SASA 값을 유지하고 있어 상대적으로 더 많은 부분이 결합되어 있음을 나타냅니다.
5. BSA (Buried Surface Area)
- 설명: 이 그래프는 삼원 복합체의 매몰 표면적(BSA)을 나타냅니다. BSA는 단백질 간 결합에 의해 내부에 매몰된 표면적을 의미하며, 단백질-단백질 결합 강도의 중요한 지표입니다.
- 분석: 7JTP (파란색) 복합체는 가장 높은 BSA 값을 유지하며, 이 복합체가 단백질 간 강한 결합을 형성하고 있음을 시사합니다. 반면에 7JTO (녹색)와 8BB4 (녹색) 복합체는 상대적으로 낮은 BSA 값을 보여줍니다.
6. MMGBSA (Molecular Mechanics Generalized Born Surface Area)
- 설명: 이 그래프는 삼원 복합체의 결합 자유 에너지를 나타내는 MMGBSA 값을 보여줍니다. MMGBSA 값이 낮을수록 결합이 더 안정적이라는 것을 의미합니다.
- 분석: 7JTP (파란색) 복합체가 가장 낮은 MMGBSA 값을 유지하며, 이 복합체가 가장 안정적인 결합을 형성하고 있음을 나타냅니다. 8BB2 (주황색)와 8BB4 (녹색) 복합체는 상대적으로 높은 MMGBSA 값을 유지하며, 덜 안정적인 결합을 나타냅니다.
이 시뮬레이션 결과에서 7JTP 복합체(파란색)가 다른 복합체들에 비해 구조적으로 가장 안정적이며, 결합 에너지도 가장 낮게 유지되어 PROTAC 설계에서 중요한 모델이 될 수 있음을 시사합니다. 반면에 8BB2와 8BB4 복합체는 더 큰 구조적 변동성과 높은 에너지 값을 보이므로, 상대적으로 덜 안정적일 수 있습니다. 이 분석을 통해 연구자들은 PROTAC의 링커 길이, 단백질-단백질 상호작용, 그리고 결합 안정성을 최적화하여 더 효과적인 삼원 복합체를 설계할 수 있습니다.
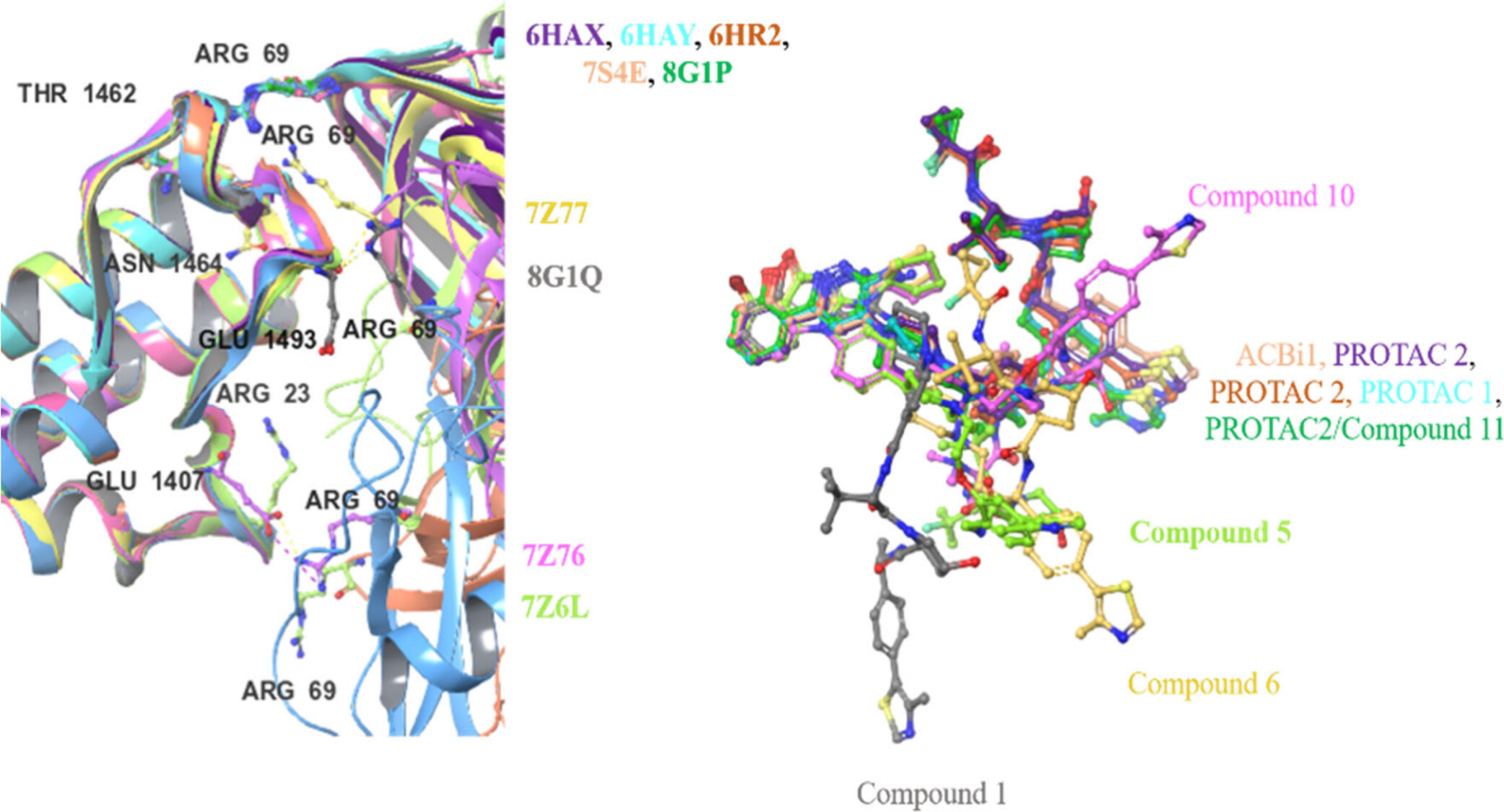
위 그림에서는 특정 PROTAC이 SMARCA2와 VHL 단백질 사이에서 삼원 복합체를 형성하는 구조적 특징을 분석하고 있습니다. 이 구조는 PROTAC의 설계가 단백질 간 결합 및 안정성에 어떤 영향을 미치는지 이해하는 데 중요한 역할을 합니다. 각각의 구성 요소를 매디캠적 관점에서 설명하겠습니다.
왼쪽: 단백질-단백질 상호작용 영역 (SMARCA2와 VHL 간의 상호작용)
- 설명: 왼쪽 그림은 SMARCA2와 VHL 사이에서 중요한 역할을 하는 아미노산 잔기들을 강조하여 보여줍니다.
- 매디캠적 분석:
- ARG 69: 이 잔기는 VHL의 중요한 상호작용 부위 중 하나로, SMARCA2와의 결합에서 핵심적인 역할을 합니다. ARG 69는 다양한 위치에서 반복적으로 나타나며, 이로 인해 단백질 간의 강력한 결합을 형성합니다.
- GLU 1493, GLU 1407: 이 두 잔기는 음전하를 띄고 있어, 양전하를 가진 ARG 잔기와 전기적 상호작용을 통해 결합을 강화할 수 있습니다. 이러한 상호작용은 단백질 복합체의 안정성을 높이는 중요한 요소입니다.
- THR 1462, ASN 1464: 이들 잔기는 특정 PROTAC의 링커와 상호작용하여 복합체의 위치를 고정하는 데 중요한 역할을 합니다.
오른쪽: PROTAC의 링커 설계와 결합 구조
- 설명: 오른쪽 그림은 다양한 PROTAC 분자들이 SMARCA2와 VHL 사이에서 어떻게 결합하는지를 보여줍니다.
- 매디캠적 분석:
- 다양한 PROTAC 구조: 여기에는 ACBi1, PROTAC 2, Compound 5, Compound 6 등이 포함됩니다. 각각의 PROTAC은 특정 링커 길이와 결합 부위를 가지고 있으며, 이들이 단백질 간 결합의 강도와 복합체의 안정성에 어떤 영향을 미치는지 시각적으로 나타냅니다.
- Compound 10 (핑크색): 이 구조는 특히 주목할 만한데, 독특한 결합 패턴을 가지고 있어 다른 PROTAC들과 비교했을 때 결합 안정성이 높거나 낮을 수 있습니다.
- 링커의 역할: 링커는 PROTAC의 두 결합 부위를 물리적으로 연결하는 역할을 하며, 길이와 유연성에 따라 단백질 복합체의 안정성에 영향을 미칩니다. 예를 들어, 긴 링커는 더 유연한 결합을 허용하지만, 지나치게 길면 결합이 불안정해질 수 있습니다. 반대로 짧은 링커는 결합의 위치를 더 정확하게 고정하지만 유연성이 부족할 수 있습니다.
이 이미지에서는 SMARCA2와 VHL 사이의 삼원 복합체에서 PROTAC이 어떻게 설계되고 작용하는지를 분석하고 있습니다. 단백질 간의 상호작용 잔기(예: ARG 69, GLU 1493)와 PROTAC의 링커 설계가 이 복합체의 형성과 안정성에 중요한 역할을 한다는 것을 알 수 있습니다. 이러한 이해는 PROTAC 설계에서 중요한 인사이트를 제공하며, 더 효과적이고 선택적인 단백질 분해제를 개발하는 데 필수적입니다. 연구자들은 이 정보를 바탕으로 특정 질병을 목표로 삼아, 단백질 분해를 최적화할 수 있는 PROTAC을 설계할 수 있습니다.
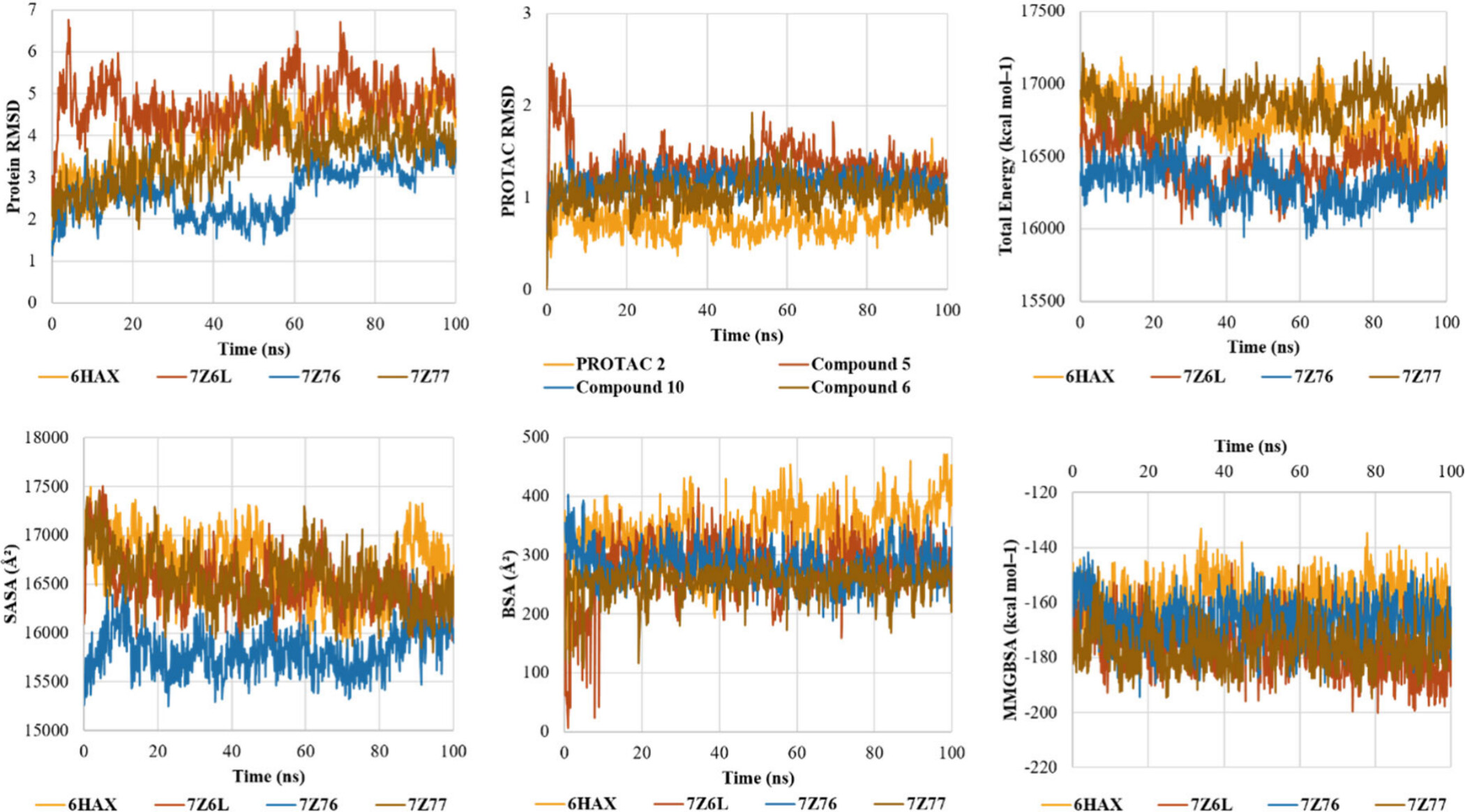
위 그래프에서는 다양한 삼원 복합체의 동역학적 안정성을 평가하기 위해 여러 가지 매개변수를 시뮬레이션한 결과를 보여줍니다. 각 그래프는 시뮬레이션 시간(나노초, ns) 동안의 특정 물리적 매개변수의 변화를 나타냅니다. 이 데이터를 통해 삼원 복합체의 구조적 안정성 및 결합 특성을 이해할 수 있습니다. 각 그래프를 차례대로 설명하겠습니다.
1. Protein RMSD (Root Mean Square Deviation)
- 설명: 이 그래프는 시뮬레이션 시간 동안 각 단백질의 구조적 변화를 RMSD 값으로 나타냅니다. RMSD 값이 낮을수록 단백질의 구조가 안정적임을 의미합니다.
- 분석:
- 7Z76 (파란색) 복합체는 가장 낮은 RMSD 값을 유지하며, 시뮬레이션 동안 가장 안정적인 구조를 보여줍니다.
- 6HAX (노란색)와 7Z6L (갈색) 복합체는 시뮬레이션 동안 더 높은 RMSD 값을 보이며, 상대적으로 불안정한 구조를 나타냅니다.
- 7Z77 (주황색) 복합체도 변동성이 크며, 구조적 안정성이 상대적으로 떨어집니다.
2. PROTAC RMSD
- 설명: 이 그래프는 시뮬레이션 동안 PROTAC 분자의 RMSD 변화를 보여줍니다. PROTAC의 RMSD 값이 낮을수록 PROTAC이 삼원 복합체에서 안정적으로 결합하고 있음을 나타냅니다.
- 분석:
- **Compound 10 (파란색)**은 가장 안정적인 PROTAC RMSD를 보여주며, 삼원 복합체 내에서 PROTAC의 결합이 매우 안정적임을 나타냅니다.
- **Compound 5 (갈색)**와 **Compound 6 (주황색)**은 RMSD 값이 더 높아 상대적으로 불안정한 결합을 보여줍니다.
3. Total Energy
- 설명: 이 그래프는 삼원 복합체의 총 에너지를 시뮬레이션 시간에 따라 나타냅니다. 총 에너지가 낮을수록 시스템이 안정적임을 나타냅니다.
- 분석:
- 7Z76 (파란색) 복합체는 시뮬레이션 동안 가장 낮은 총 에너지를 유지하며, 가장 안정적인 시스템을 나타냅니다.
- 6HAX (노란색)과 7Z6L (갈색) 복합체는 더 높은 에너지를 보이며, 덜 안정적임을 나타냅니다.
4. SASA (Solvent Accessible Surface Area)
- 설명: 이 그래프는 삼원 복합체의 용매 접근 가능 표면적(SASA)을 나타냅니다. SASA는 단백질 표면에서 용매에 노출된 부분의 면적을 나타내며, 결합의 강도와 관련이 있습니다.
- 분석:
- 7Z76 (파란색) 복합체는 가장 낮은 SASA 값을 유지하며, 더 많은 표면이 단백질 간 결합으로 인해 매몰되어 있음을 시사합니다.
- 6HAX (노란색)과 7Z6L (갈색) 복합체는 더 높은 SASA 값을 보이며, 상대적으로 더 많은 부분이 용매에 노출되어 있음을 나타냅니다.
5. BSA (Buried Surface Area)
- 설명: 이 그래프는 단백질 간의 매몰된 표면적(BSA)을 나타냅니다. BSA가 높을수록 단백질 간의 상호작용이 더 강력하다는 것을 의미합니다.
- 분석:
- 7Z76 (파란색) 복합체는 가장 높은 BSA 값을 유지하며, 강력한 단백질 간 상호작용을 나타냅니다.
- 6HAX (노란색)과 7Z6L (갈색) 복합체는 더 낮은 BSA 값을 보입니다.
6. MMGBSA (Molecular Mechanics Generalized Born Surface Area)
- 설명: 이 그래프는 삼원 복합체의 결합 자유 에너지를 나타냅니다. MMGBSA 값이 낮을수록 결합이 더 안정적임을 의미합니다.
- 분석:
- 7Z76 (파란색) 복합체는 가장 낮은 MMGBSA 값을 유지하며, 결합이 가장 안정적임을 나타냅니다.
- **6HAX (노란색)**은 더 높은 MMGBSA 값을 보이며, 결합 안정성이 떨어짐을 나타냅니다.
이 시뮬레이션 결과에서 7Z76 (파란색) 복합체가 다른 복합체들에 비해 가장 구조적으로 안정적이며, 에너지적으로도 안정적임을 알 수 있습니다. 반면에 **6HAX (노란색)**와 7Z6L (갈색) 복합체는 상대적으로 불안정한 구조를 나타내며, 삼원 복합체로서의 안정성이 낮을 수 있음을 시사합니다. 이러한 분석은 PROTAC 설계 및 최적화에 중요한 기초 자료를 제공하며, 효과적인 단백질 분해제를 개발하는 데 도움을 줄 수 있습니다.
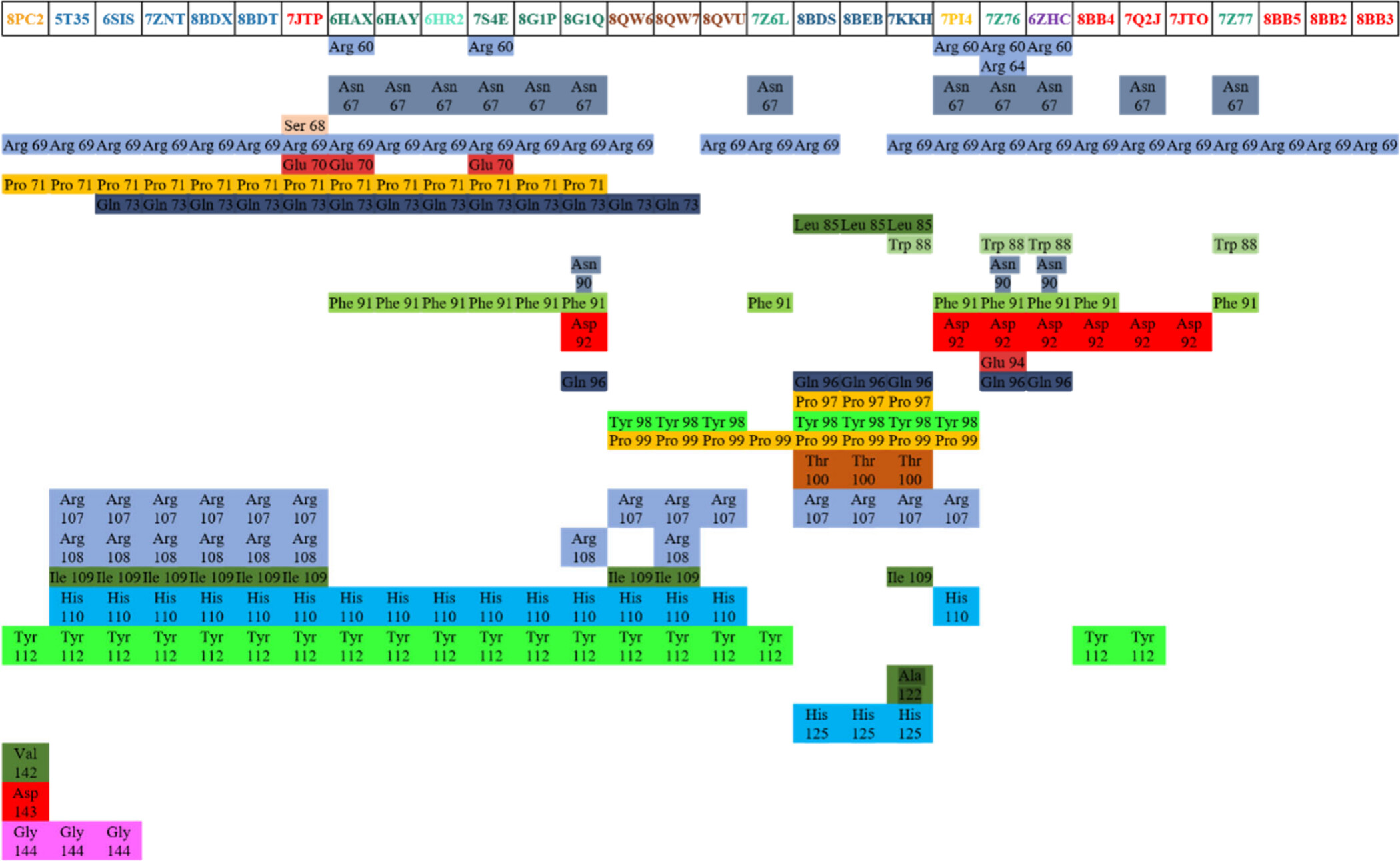
위 그림은 다양한 삼원 복합체에서 나타나는 아미노산 잔기 간의 상호작용을 색상으로 코드화하여 시각적으로 나타낸 것입니다. 이 표는 각 복합체에서 특정 아미노산이 어떻게 결합에 관여하는지를 보여줍니다. 이를 통해 단백질-단백질 또는 단백질-리간드 간의 결합 위치와 주요 상호작용 부위를 이해할 수 있습니다.
색상 코드와 상호작용 분석:
- 파란색 (Arg 69 등): Arg 69는 여러 복합체에서 공통적으로 관여하는 중요한 잔기로, 주로 양전하를 띄며 다른 음전하 잔기와 전기적 상호작용을 통해 결합을 강화합니다.
- 노란색 (Pro 71 등): Pro 71은 결합에서 중요한 역할을 하는 프로린 잔기로, 구조적으로 고정된 위치를 제공하여 복합체의 안정성을 높일 수 있습니다.
- 녹색 (Phe 91 등): Phe 91과 같은 페닐알라닌 잔기는 주로 소수성 상호작용을 통해 단백질 간 결합을 촉진합니다. 이는 결합의 내구성을 증가시킬 수 있습니다.
- 빨간색 (Asp 92 등): Asp 92와 같은 아스파트산 잔기는 음전하를 띄고 있어, 양전하를 가진 잔기들과의 상호작용을 통해 결합의 선택성과 강도를 조절합니다.
- 청록색 (His 110 등): His 110은 히스티딘 잔기로, pH에 따라 양전하 또는 중성 전하를 가질 수 있어 다양한 환경에서 유연한 결합을 가능하게 합니다.
- 회색 (Asn 67 등): Asn 67은 아스파라진 잔기로, 주로 수소 결합을 통해 안정성을 제공하는 역할을 합니다.
구체적인 복합체 분석:
- 상단의 다양한 박스들: 각 박스는 특정 삼원 복합체를 나타내며, 이들 복합체에서 사용된 단백질-리간드 결합 패턴을 보여줍니다. 각 아미노산 잔기가 어떻게 복합체 형성에 기여하는지를 이해하는 데 도움이 됩니다.
- 복합체 간 비교: 같은 아미노산 잔기들이 여러 복합체에서 반복적으로 나타난다는 것은 이들이 결합 형성에 필수적임을 시사합니다. 예를 들어, Arg 69는 많은 복합체에서 중요한 역할을 하며, 이는 이 잔기가 결합 안정성에 중요한 기여를 한다는 것을 나타냅니다.
이 표는 특정 아미노산 잔기가 단백질-단백질 또는 단백질-리간드 상호작용에서 어떤 역할을 하는지를 이해하는 데 중요한 정보를 제공합니다. 이러한 정보는 신약 개발에서 중요한 역할을 하며, 특정 타겟 단백질과의 결합을 최적화하기 위해 어떤 아미노산 잔기가 중요한지를 결정하는 데 도움을 줍니다. 이를 통해 더 강력하고 선택적인 약물 후보를 설계할 수 있습니다.
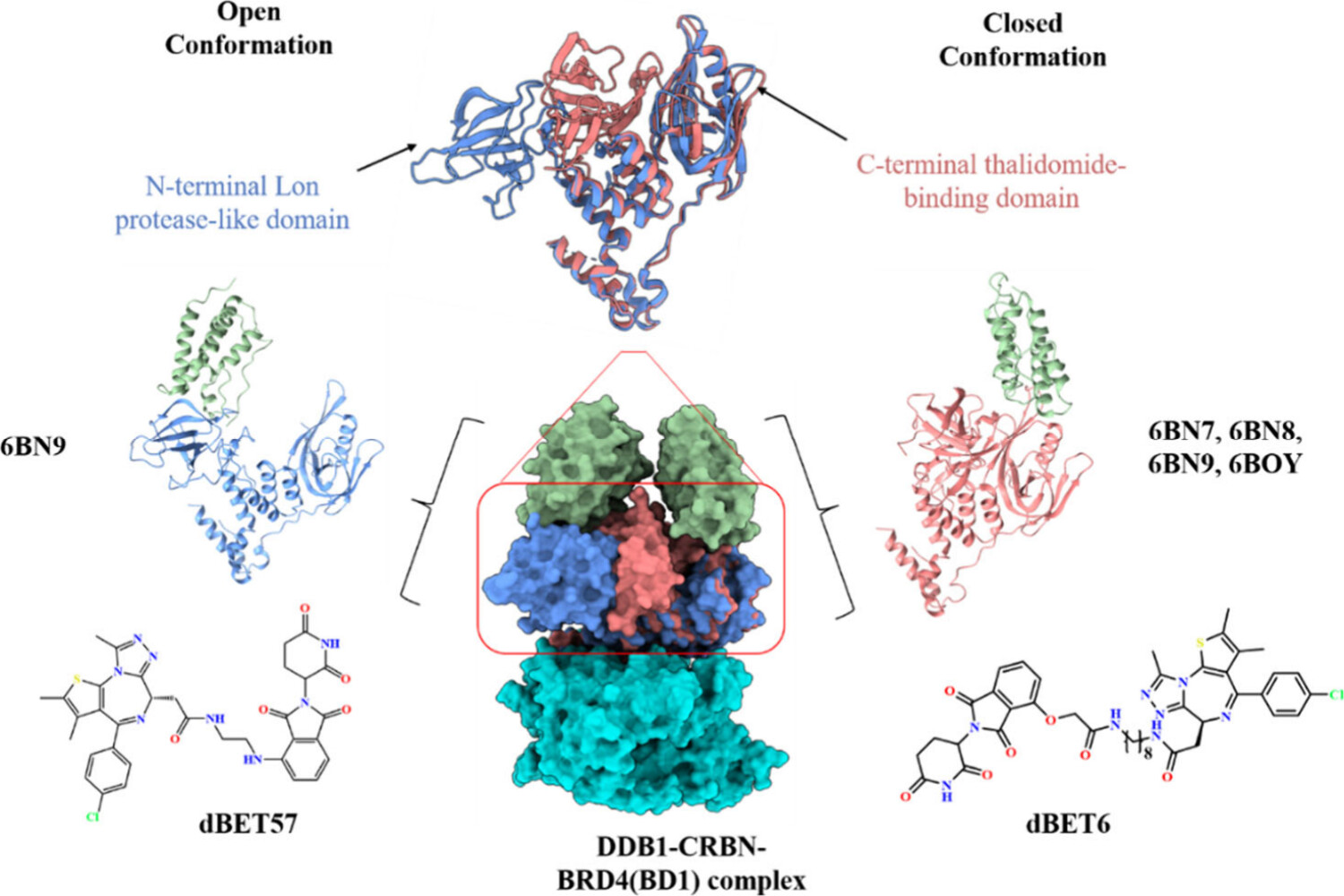
위 그림은 CRBN 단백질의 열린(conformation)과 닫힌(conformation) 구조를 보여주고 있으며, 이 구조가 단백질 복합체 형성과 PROTAC 설계에 어떻게 영향을 미치는지를 시각적으로 설명하고 있습니다. 이를 매디캠적 관점에서 자세히 설명하겠습니다.
1. Open Conformation vs Closed Conformation
- Open Conformation (왼쪽 상단): CRBN 단백질의 N-terminal Lon protease-like 도메인은 열린 상태에서 표면에 노출되어 있으며, 이때 단백질 복합체 형성에 적합하지 않습니다. 이 구조는 다소 유연하고 다양한 결합 부위를 허용하지만, 특정 단백질 타겟에 대해 높은 결합 친화도를 제공하지 않을 수 있습니다.
- Closed Conformation (오른쪽 상단): C-terminal thalidomide-binding 도메인이 닫힌 상태에서 결합 부위가 더 구체적이고 강력하게 형성됩니다. 이 구조는 단백질 타겟과 강력한 결합을 형성할 수 있으며, 특히 PROTAC 분자가 결합할 때 높은 안정성을 제공합니다.
2. DDB1-CRBN-BRD4(BD1) Complex (중앙)
- 설명: 이 구조는 DDB1, CRBN, 그리고 BRD4(BD1) 단백질로 이루어진 삼원 복합체를 나타냅니다. 중앙의 빨간색 박스는 이 복합체에서 CRBN 단백질이 어떻게 중요한 역할을 하는지를 강조하고 있습니다. 이 복합체는 PROTAC 분자가 단백질 타겟과 결합하여 유비퀴틴화(ubiquitination)를 통해 타겟 단백질의 분해를 유도하는 과정에서 핵심적인 역할을 합니다.
- 매디캠적 분석:
- PROTAC 분자의 역할: 이 복합체에서 PROTAC은 BRD4(BD1)와 CRBN을 연결하여 BRD4(BD1)의 분해를 촉진합니다. 이를 통해 선택적으로 타겟 단백질을 분해할 수 있으며, 이는 암과 같은 질병 치료에 매우 유용한 전략이 될 수 있습니다.
- 구조적 안정성: CRBN이 닫힌 상태에서 이러한 삼원 복합체가 더 안정적으로 유지되며, PROTAC의 효능이 증가합니다.
3. dBET57 및 dBET6 (하단의 화학 구조)
- 설명: 하단의 dBET57과 dBET6는 각각의 PROTAC 분자의 화학 구조를 보여줍니다.
- 매디캠적 분석:
- dBET57 (왼쪽): dBET57은 비교적 짧은 링크를 가지고 있으며, 이는 CRBN의 열린 구조(conformation)에서 더 효과적일 수 있습니다. 이 구조는 특정 타겟 단백질과의 상호작용을 최적화하여 분해 효율성을 높입니다.
- dBET6 (오른쪽): dBET6은 더 긴 링크를 가지고 있으며, CRBN의 닫힌 구조(conformation)에서 더 효과적으로 작용할 수 있습니다. 이 구조는 더 안정적인 단백질 복합체를 형성하여, 분해 과정을 더욱 효율적으로 만듭니다.
위 그림에서는 CRBN 단백질이 열린 구조와 닫힌 구조 사이에서 어떻게 변화하며, 이 변화가 PROTAC 설계와 단백질 분해 효율성에 어떤 영향을 미치는지를 명확하게 보여줍니다. PROTAC 분자의 길이와 구조는 CRBN의 상태에 따라 최적화될 수 있으며, 이는 특정 질병 타겟에 대한 선택적이고 효과적인 치료 전략을 개발하는 데 중요한 요소입니다.
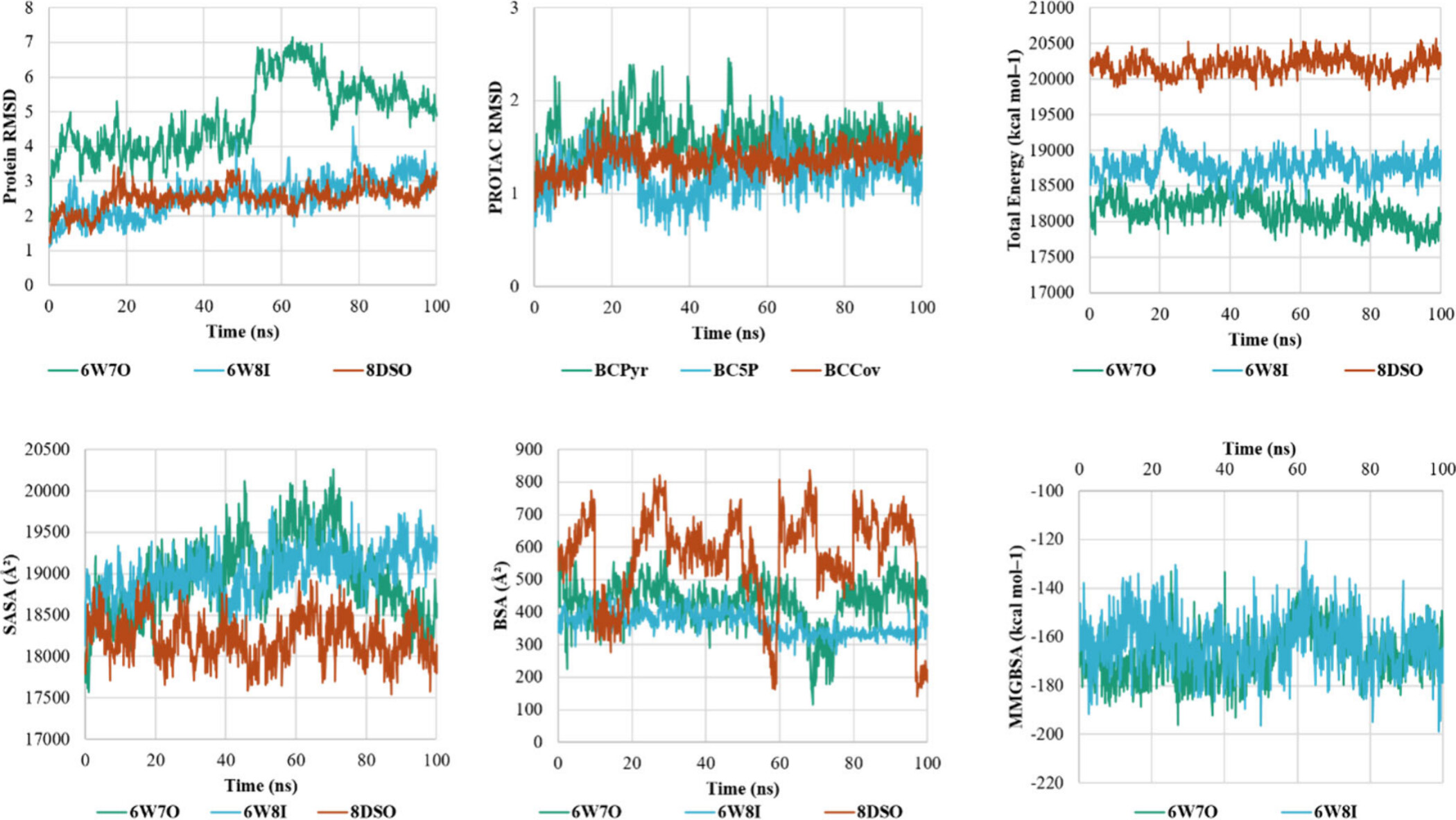
위 그림은 BTK (Bruton's tyrosine kinase)와 cIAP (cellular inhibitor of apoptosis protein) 단백질이 PROTAC (proteolysis targeting chimera) 분자들과 함께 결합할 때의 동적 변화를 시뮬레이션한 결과를 보여줍니다. 시뮬레이션은 각 PROTAC이 결합한 후 복합체의 안정성을 평가하기 위해 수행되었습니다. 각 차트는 시간에 따른 다양한 물리적 파라미터를 나타내며, 이를 통해 PROTAC 분자의 결합 강도와 복합체의 안정성을 평가할 수 있습니다.
1. Protein RMSD (Root Mean Square Deviation)
- 설명: 이 그래프는 시뮬레이션 시간 동안 단백질의 구조적 변화를 나타냅니다. 단백질의 RMSD 값이 낮을수록 구조가 안정적임을 의미합니다.
- 분석:
- 6W7O (녹색)와 6W8I (파란색)의 RMSD는 시간이 지남에 따라 상대적으로 안정적으로 유지되지만, 8DSO (갈색)는 더 큰 변동을 보입니다. 이는 8DSO가 결합한 PROTAC이 복합체의 구조를 더 불안정하게 만든다는 것을 의미할 수 있습니다.
2. PROTAC RMSD
- 설명: 이 그래프는 시뮬레이션 시간 동안 PROTAC 분자의 구조적 변화를 나타냅니다.
- 분석:
- BCPyr (녹색), BC5P (파란색), BCCov (갈색) 모두 시뮬레이션 동안 비교적 안정적이었으나, BCPyr가 가장 낮은 변동을 보여 PROTAC 분자들 중에서 가장 안정적인 결합을 형성했음을 나타냅니다.
3. Total Energy
- 설명: 이 그래프는 시뮬레이션 동안 복합체의 총 에너지를 나타냅니다. 더 낮은 에너지는 더 안정적인 결합을 의미합니다.
- 분석:
- 8DSO (갈색)의 총 에너지가 가장 낮아, 이 복합체가 가장 안정적임을 시사합니다.
4. SASA (Solvent Accessible Surface Area)
- 설명: 이 그래프는 단백질 복합체의 표면적이 용매에 노출된 부분을 나타냅니다. 높은 SASA는 단백질이 더 확장된 상태임을 의미할 수 있습니다.
- 분석:
- 6W8I (파란색)와 6W7O (녹색)는 비슷한 SASA 값을 유지하는 반면, 8DSO (갈색)는 더 낮은 SASA 값을 보여주며, 이 복합체가 더 압축된 구조를 형성했음을 나타냅니다.
5. BSA (Buried Surface Area)
- 설명: 이 그래프는 복합체의 내부 표면적이 얼마나 묻혀 있는지를 나타냅니다. 높은 BSA는 더 강한 상호작용을 의미할 수 있습니다.
- 분석:
- 8DSO (갈색)의 BSA가 가장 높아, 이 복합체가 가장 많은 내부 상호작용을 형성하고 있음을 보여줍니다. 이는 안정성이 높은 결합을 시사합니다.
6. MMGBSA (Molecular Mechanics Generalized Born Surface Area)
- 설명: 이 그래프는 시뮬레이션 동안 결합 자유 에너지를 나타냅니다. 더 낮은 에너지는 더 강한 결합을 의미합니다.
- 분석:
- 6W8I (파란색)가 가장 낮은 MMGBSA 값을 보여, 이 복합체가 가장 강한 결합을 형성하고 있음을 나타냅니다.
이 시뮬레이션 결과는 BCCov (8DSO)가 가장 안정적인 결합을 형성하며, 6W8I와 6W7O도 비교적 안정적인 결합을 유지한다는 것을 보여줍니다. 이러한 정보는 PROTAC 설계에서 중요한 역할을 하며, 더 안정적이고 효과적인 약물 후보를 개발하는 데 기여할 수 있습니다.
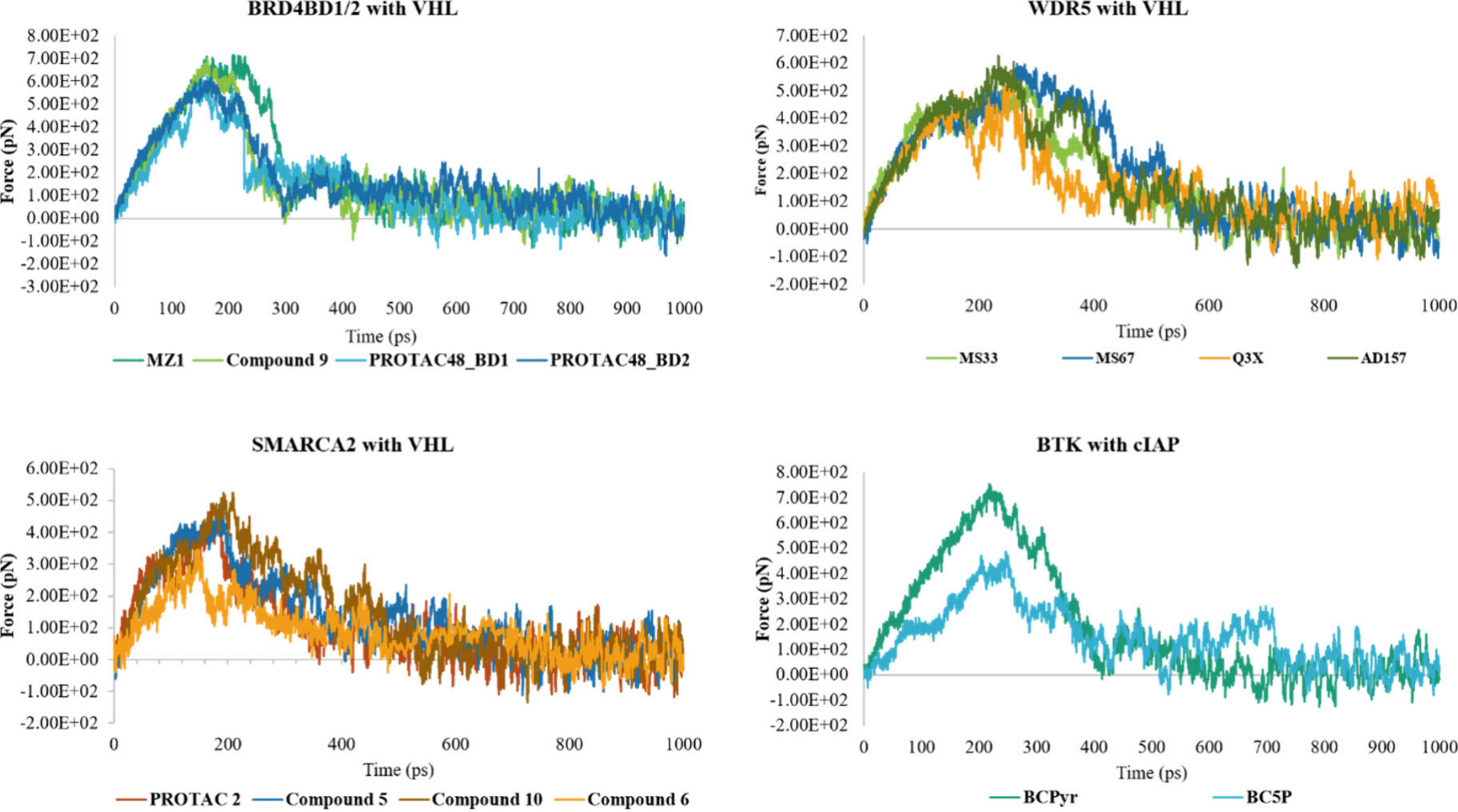
각 그래프는 서로 다른 PROTAC (Proteolysis-Targeting Chimeras) 분자들이 다양한 타겟 단백질들과 결합할 때의 힘(Force)을 시간에 따라 측정한 것입니다. 각 그래프는 특정 단백질-프로탁 복합체의 결합 강도를 나타내며, 이는 분자가 단백질로부터 얼마나 강하게 당겨졌는지를 보여줍니다.
1. BRD4BD1/2 with VHL
- 설명: 이 그래프는 BRD4BD1/2 단백질과 VHL (Von Hippel-Lindau) E3 리가아제가 결합했을 때의 힘을 나타냅니다.
- 분석:
- MZ1: 이 프로탁 분자는 초기 단계에서 힘이 급격히 상승하여 높은 피크를 형성한 후, 서서히 감소하며 안정적인 상태에 도달합니다.
- Compound 9, PROTAC48_BD1, PROTAC48_BD2: 이들 모두 유사한 패턴을 보이지만, 각자의 피크 강도와 안정성에서 차이가 있습니다. 특히 PROTAC48_BD1은 상대적으로 높은 피크를 보이며, 더 큰 힘이 필요함을 시사합니다.
2. WDR5 with VHL
- 설명: 이 그래프는 WDR5 단백질과 VHL E3 리가아제 간의 결합 강도를 나타냅니다.
- 분석:
- MS33, MS67, Q3X, AD157: 이들 PROTAC 분자들은 모두 유사한 패턴으로 힘이 상승하며, 피크에 도달한 후 서서히 안정화됩니다. MS67과 AD157이 비교적 더 높은 힘을 보여주며, 이는 더 강한 결합을 의미할 수 있습니다.
3. SMARCA2 with VHL
- 설명: 이 그래프는 SMARCA2 단백질과 VHL E3 리가아제 간의 결합 강도를 나타냅니다.
- 분석:
- PROTAC 2, Compound 5, Compound 10, Compound 6: 각각의 PROTAC 분자는 결합 초기에는 빠르게 힘이 증가하지만, 시간이 지남에 따라 감소합니다. 특히 Compound 5는 다른 PROTAC들보다 더 큰 피크를 보이며, 이는 더 큰 결합 강도를 의미합니다.
4. BTK with cIAP
- 설명: 이 그래프는 BTK (Bruton’s tyrosine kinase) 단백질과 cIAP (cellular Inhibitor of Apoptosis Protein) E3 리가아제 간의 결합 강도를 나타냅니다.
- 분석:
- BCPyr, BC5P: BCPyr이 더 큰 피크를 보이며, 이는 더 강한 결합을 나타냅니다. BC5P는 초기 힘이 상승한 후 감소하는 패턴을 보이며, 상대적으로 낮은 피크를 형성합니다.
이 그래프들은 각각의 PROTAC 분자가 특정 타겟 단백질과 결합했을 때의 힘을 나타내며, 이는 PROTAC의 결합 강도와 효율성을 평가하는 데 중요한 지표가 됩니다. 더 높은 피크는 더 강한 결합을 의미하며, 이는 PROTAC이 더 효과적으로 단백질을 타겟팅하고 분해할 가능성을 시사합니다.
논문 요약
BRD4-BD1과 BRD4-BD2가 VHL과 결합할 때 나타나는 구조적 동태와 상호작용이 중요하며, 이는 링크 길이와 인터페이스 잔기에 의해 영향을 받습니다. SMARCA2/4의 경우, 링크와 결합 단편들이 복합체의 특징을 결정하며 SMARCA2를 선택적으로 분해할 수 있는 잠재력을 가집니다. VHL이 포함된 복합체에서는 Arg69 주변의 극성 잔기들과의 상호작용이 중요하며, 독특한 링크들이 타겟 단백질과 E3 리가아제를 결합시켜 특정한 3D 구조를 형성하고 단백질 분해를 촉진합니다.
CRBN을 활용한 BRD4-BD1 분해에서는 CRBN의 열림과 닫힘에 따른 동적인 상호작용이 삼원 복합체 형성과 선택성에 영향을 미칩니다. VHL과 CRBN이 BRD4-BD1/2를 동시에 분해할 때 공통의 결합 패턴이 나타나며, cIAP이 중재하는 BTK 분해에서도 유사한 결합 특징이 관찰됩니다. 분자 동역학(MD) 시뮬레이션을 통해 안정적이고 효율적인 삼원 복합체의 동작이 설명되며, 이는 분해 가능한 복합체를 예측하는 데 중요한 역할을 합니다. 안정적이고 협력적인 삼원 복합체를 보장하려면 인터페이스 잔기, 독특한 링크 구조, 최적의 링크 길이, 높은 활성 화합물과의 균형 잡힌 협력성이 필요합니다.
'Company' 카테고리의 다른 글
| 🔍 다중 회귀 분석으로 용해도 예측하기: 신약 개발에서의 효율적인 합성 우선순위 결정법 💊 (0) | 2024.08.14 |
|---|---|
| CW-3308의 개발: 선택적이고 경구투여 가능한 BRD9 PROTAC 분해제 (0) | 2024.08.13 |
| 소노가시라 반응(Sonogashira cross coupling) 메카니즘 (0) | 2022.11.24 |
| 핵 리액션 (Heck reaction) 메카니즘 (0) | 2022.11.24 |
| 스즈키 크로스 커플링 반응 (Suzuki reaction) 메카니즘 (0) | 2022.11.16 |

